1、选择题 常温下,①PH=10氨水 ②PH=10氢氧化钠溶液 ③PH=4 HA溶液 ④PH=4 HB溶液,对下列四种溶液的叙述正确的是
[? ]
A.②、④两溶液相比,两者的Kw相同,水的电离程度不相同
B.若酸性HA比HB的强,则等物质的量浓度的NaA、NaB溶液PH:NaA>NaB
C.一定体积①、10mL③ 两溶液混合,PH=7,V总≥20mL
D.等体积的②,分别用③、④中和,消耗酸溶液的体积V③>V④,则说明HA的酸性比HB的酸性强
2、选择题 将一定量下列溶液混合后加热蒸干并灼烧,所得固体不可能为纯净物的是( )
A.Fe2(SO4)3?FeSO4
B.KHCO3?KOH
C.NH4Cl?NaCl
D.AlCl3?Al2(SO4)3
3、选择题 将0.2mol/LCH3COONa与0.1mol/LHCl等体积混合,混合后溶液的pH小于7。(假设体积变化忽略不计)则溶液中下列微粒的物质的量浓度关系正确的是:
[? ]
A.c(CH3COO-)+(CH3COOH)= 0.2mol/L
B.c(Cl-)+c(CH3COO-)>0.1mol/L
C.c(OH-)+c(Cl-)=c(H+)+c(CH3COOH)
D.c(Cl-)>c(CH3COO-)>c(CH3COOH)>c(H+)
4、选择题 物质的量浓度相同的下列溶液中,符合按pH由小到大顺序排列的是
[? ]
A.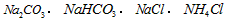
B.
C.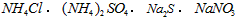
D.
5、填空题 25℃时,将0.01molCH3COONa和0.002molHCl溶于水,形成1L混合溶液:
(1)该溶液中存在着三个平衡体系,用电离方程式或离子方程式表示:
①_________________,②_________________,③_________________。
(2)溶液中共有___________种粒子(指分子和离子)
(3)在这些粒子中,浓度是0.01 mol·L-1的是_____________,浓度是0.002 mol·L-1的是___________。
(4)___________和___________物质的量之和等于0.01mol。