1、实验题 用下图所示装实验置进行铜与浓硫酸反应的实验探究,请回答下列问题:
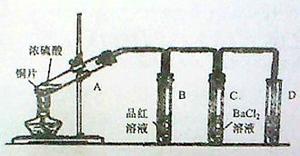
(1)试管A中发生反应的化学方程式为?。
(2)试管B中的实验现象是?,将试管B中反应后的溶液进行加热,观察到试管B中的实验现象是?。
(3)反应一段时间后,试管C中没有观察到沉淀生成,若往试管C中通入或加入一种物质X,即生成白色沉淀,该物质X不可能是下列的?。(填序号)
a、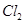 ? b、
? b、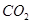 ? c、
? c、 ? d、
? d、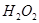
(4)试管A中的铜和硫酸充分反应后,铜和硫酸都有剩余,下列物质中能使试管A中的铜片继续溶解的是?。(填序号)
a、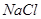 ? b、
? b、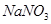 ? c、
? c、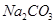 ? d、
? d、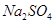
(5)试管D中的试剂是?溶液,其作用是?。
参考答案:(13分)(1)Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑(3分)
CuSO4+2H2O+SO2↑(3分)
(2)品红溶液褪色;品红溶液又恢复为原来的颜色
(3) c?;(4) b?;(5)? NaOH溶液;吸收二氧化硫气体
本题解析:(1)浓硫酸具有强氧化性,能氧化金属铜,则试管A中发生反应的化学方程式为Cu+2H2SO4(浓) CuSO4+2H2O+SO2↑。
CuSO4+2H2O+SO2↑。
(2)SO2具有漂白性,则试管B中的实验现象是品红溶液褪色;由于SO2的漂白性是不稳定的,则在加热的条件下又恢复到原来的颜色,则将试管B中反应后的溶液进行加热,观察到试管B中的实验现象是品红溶液又恢复为原来的颜色。
(3)SO2溶于水生成亚硫酸,溶液显酸性,得不到亚硫酸钡白色沉淀。因此要生成白色沉淀则可以加入氧化剂或碱性气体,即选项abd都可以,其中ad生成的是硫酸钡白色沉淀,c是的亚硫酸钡白色沉淀,答案选b。
(4)在酸性条件下,硝酸盐具有强氧化性,能氧化单质铜,因此加入的物质是硝酸钠,答案选b。
(5)SO2是大气污染物,应该用氢氧化钠溶液吸收,防止污染空气。
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,基础性强,在注重对学生基础知识巩固和训练的同时,侧重对学生能力的培养。有利于培养学生的逻辑推理能力和规范严谨的实验设计能力,也有助于调动学生的学习兴趣和学习积极性。
本题难度:一般
2、选择题 下列物质中,既可利用化合反应,又可利用溶液中的复分解反应制取的是
A.Al2S3
B.Fe2S3
C.FeCl3
D.CuS
参考答案:C
本题解析:Al2S3在水中完全水解,不能利用溶液中的复分解反应制取,A不符合要求;Fe与S化合生成FeS,B不符合要求;Fe与Cl2化合能生成FeCl3,Fe2(SO4)3与BaCl2在溶液中发生复分解反应能生成FeCl3,C符合要求;Cu与S化合生成Cu2S,D不符合要求。
本题难度:简单
3、选择题 标准状况下H2S和O2混合气体100mL,经点燃后反应至完全,所得气体经干燥后,恢复到原来状况时体积为10mL,该10mL气体可能是?(?)

A.H2S、SO2
B.O2
C.H2S
D.SO3
参考答案:C
本题解析: H2S和O2反应后的气体产物可能为①H2S;②SO2;③SO2和O2。
H2S和O2反应后的气体产物可能为①H2S;②SO2;③SO2和O2。
 如为情况①,说明H2S过量。
如为情况①,说明H2S过量。
 则由:2H2S+O2=2H2O+2S体积减少
则由:2H2S+O2=2H2O+2S体积减少
 2? 1? 3
2? 1? 3
 ?60?30? 100-10="90?"
?60?30? 100-10="90?"
 参加反应的H2S和O2的总体积为60+30=90,则余下的10mL气体为H2S。
参加反应的H2S和O2的总体积为60+30=90,则余下的10mL气体为H2S。
 若为情况②或③,说明O2过量。
若为情况②或③,说明O2过量。

 则由:2H2S+3O2=2H2O+2SO2体积减少
则由:2H2S+3O2=2H2O+2SO2体积减少
 ? 2? 3? 2? 3
? 2? 3? 2? 3
 ??60 ??90??90
??60 ??90??90
 则参加反应的H2S和O2的总体积为60+90=150>100,所以这两种情况不存在。
则参加反应的H2S和O2的总体积为60+90=150>100,所以这两种情况不存在。
本题难度:一般
4、填空题 某学生对SO2与漂粉精的反应进行实验探究:
操作
| 现象
|
取4g漂粉精固体,加入100mL水
| 部分固体溶解,溶液略有颜色
|
过滤,测漂粉精溶液的pH
| pH试纸先变蓝(约为12),后褪色
|
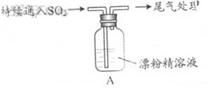
| 液面上方出现白雾;
稍后,出现浑浊,溶液变为黄绿色;
稍后,产生大量白色沉淀,黄绿色褪去
|
(1)C12和Ca(OH)2制取漂粉精的化学方程是?。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是?。
(3)向水中持续通入SO2,未观察到白雾。推测现象i的白雾由HC1小液滴形成,进行如下实验:
a.用湿润的碘化钾淀粉试纸检验白雾,无变化;
b.用酸化的AgNO3溶液检验白雾,产生白色沉淀。
① 实验a目的是?。
②由实验a、b不能判断白雾中含有HC1,理由是?。
(4)现象ii中溶液变为黄绿色的可能原因:随溶液酸性的增强,漂粉精的有效成分和C1-发生反应。通过进一步实验确认了这种可能性,其实验方案是?。
(5)将A瓶中混合物过滤、洗涤,得到沉淀X
①向沉淀X中加入稀HC1,无明显变化。取上层清液,加入BaC12溶液,产生白色沉淀。则沉淀X中含有的物质是?。
②用离子方程式解释现象iii中黄绿色褪去的原因:?。
参考答案:(1)2Cl2+2Ca(OH)2 =Ca(ClO)2+CaCl2+2H2O。(2)漂白性。(3)①检验氯气。②SO2也能和酸化的硝酸银生成白沉。 (4)要证明现象II中黄绿色为溶液酸性的增强引起的,可以在原溶液中滴加稀硫酸,观察溶液的颜色变化即可。(5)①CaSO4。②Cl2+SO2+2H2O===2Cl-+4H++ SO42-。
本题解析:(1)考查氯气与石灰乳的反应,基础方程式2Cl2+2Ca(OH)2 =Ca(ClO)2+CaCl2+2H2O(2)漂粉精中ClO-水解显碱性、同时具有漂白性(3)用湿润的淀粉碘化钾试纸可以检验氯气,不能说明白雾为HCl的原因为:SO2也能和酸化的硝酸银生成白沉(4)要证明现象II中黄绿色为溶液酸性的增强引起的,可以在原溶液中滴加稀硫酸,观察溶液的颜色变化即可(5)X为CaSO4黄色褪去的方程式也为基础方程式Cl2+SO2+2H2O=2Cl-+4H++ SO42-
(1)C12和Ca(OH)2制取漂粉精的化学方程是2Cl2+2Ca(OH)2 =Ca(ClO)2+CaCl2+2H2O。
(2)pH试纸颜色的变化说明漂粉精溶液具有的性质是漂白性。
(3)① 实验a目的是检验氯气。
②由实验a、b不能判断白雾中含有HC1,理由是SO2也能和酸化的硝酸银生成白沉。
(4)要证明现象II中黄绿色为溶液酸性的增强引起的,可以在原溶液中滴加稀硫酸,观察溶液的颜色变化即可。
(5)①CaSO4。②Cl2+SO2+2H2O===2Cl-+4H++ SO42-。
本题以非金属化合物的性质为载体考查综合实验。
本题难度:一般
5、选择题 向某溶液中加入BaCl2溶液,再加入稀硝酸,产生的白色沉淀不消失,下列叙述正确的是(?)
A.溶液中一定含有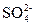
B.溶液中一定含有Ag+
C.溶液中一定含有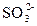
D.溶液中可能含有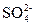 、
、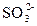 、Ag+中的某一种、两种或三种
、Ag+中的某一种、两种或三种
参考答案:D
本题解析:BaCl2溶液中的Cl-可与Ag+产生不溶于稀硝酸的白色沉淀AgCl;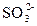 遇到稀HNO3会将其氧化成
遇到稀HNO3会将其氧化成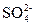 ,所以溶液中如果含有
,所以溶液中如果含有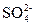 、
、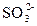 、Ag+中的某一种、两种或三种都会产生上述现象。
、Ag+中的某一种、两种或三种都会产生上述现象。
本题难度:简单