1、选择题 某学生课外活动小组利用右图装置做如下实验:在试管中注入某无色溶液,加热试管,溶液颜色变为红色,冷却后恢复无色,则原溶液可能是
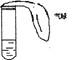
A.溶有SO2的品红溶液
B.溶有NH3的酚酞溶液
C.溶有SO2的酚酞溶液
D.溶有Cl2的品红溶液
参考答案:A
本题解析:A.二氧化硫能使品红褪色,加热溶液二氧化硫从水中脱离,品红溶液恢复红色;
B.因为无色酚酞试液遇氨水显红色,由于氨水具有挥发性,所以当加热时,氨水中的氨分子运动到气球中,溶液中没有氨分子了,故溶液由红色变成无色;
C.溶有SO2的酚酞溶液为无色,加热溶液二氧化硫从水中脱离,酚酞溶液本身为无色;
D.溶有Cl2的品红溶液,Cl2靠强氧化性将品红溶液氧化成无色物质,且这一过程不可恢复。
本题难度:一般
2、实验题 实验室可用碳酸钠制备少量亚硫酸钠晶体,有关装置如下图所示:
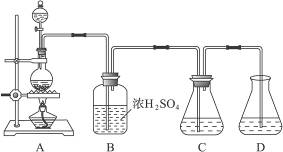
将17 g Na2CO3溶于80 mL水中,分装在C、D两个锥形瓶中,再将25 g铜屑放入圆底烧瓶中,将60 mL浓H2SO4和10 mL水的混合液装在分液漏斗中,逐滴加入硫酸后,小心加热使SO2逐渐产生(注意控制气量大小和反应速率的快慢)。将SO2通入Na2CO3溶液中至饱和,在合并C、D两瓶所得溶液中,慢慢加入17 g Na2CO3,蒸发浓缩,冷却后得亚硫酸钠晶体。试回答:
(1)如何配制60 mL浓H2SO4与10 mL水的混合液?
(2)装置B中浓H2SO4的作用:______________________________________________________;
(3)Na2SO3溶液要分装在两个锥形瓶中的理由是__________________;写出C中发生反应的离子方程式__________________;
(4)控制SO2产生速度的方法是_____________________________________________;
(5)通SO2结束后,加Na2CO3的目的是____________________________________。
参考答案:(1)取10 mL蒸馏水放在烧杯中,沿烧杯壁将60 mL浓H2SO4缓缓注入水中,同时不断搅拌。
(2)干燥,且可根据放出气体的快慢程度判断SO2的生成速度
(3)充分吸收SO2? 2SO2+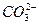 +H2O====CO2↑+
+H2O====CO2↑+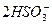
(4)观察B中出现气体的快慢,通过加热控制反应速度,当B中气体放出过快,可移去酒精灯,待缓和后再用小火加热
(5)使NaHSO3转化为Na2SO3
本题解析:浓H2SO4为氧化性酸,与Cu反应生成SO2,SO2的水溶液为H2SO3,H2SO3的酸性比H2CO3强,SO2与Na2CO3溶液作用可产生Na2SO3和CO2,其反应方程式分别为Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O,SO2+Na2CO3====Na2SO3+CO2↑。
CuSO4+SO2↑+2H2O,SO2+Na2CO3====Na2SO3+CO2↑。
本题难度:简单
3、选择题 检验Na2SO3已完全变质最适宜选用的试剂是
A.氯化钡
B.盐酸
C.氯化钡和盐酸
D.盐酸和品红
参考答案:D
本题解析:检验Na2SO3已完全变质最适宜选用的试剂:盐酸和品红;取样品少许于试管中,加入品红溶液少许,再加入盐酸,如能产生能使品红溶液褪色的气体,则证明未完全变质;如加盐酸无明显现象,则样品已经完全变质。
本题难度:简单
4、实验题 (本题16分)Ⅰ。某实验小组同学为了探究铜与浓硫酸的反应,进行了如下系列实验。
【实验1】铜与浓硫酸反应,实验装置如图所示。
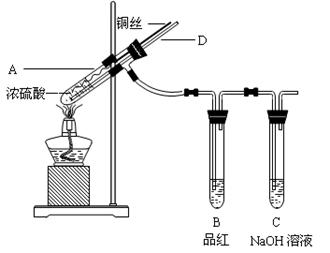
实验步骤:
①先连接好装置,检验气密性,加入试剂;
②加热A试管直到B中品红褪色,熄灭酒精灯;
③将Cu丝上提离开液面。
(1)装置A中发生反应的化学方程式为?。
(2)熄灭酒精灯后,因为有导管D的存在,B中的液体不会倒吸,其原因是?。
(3)拆除装置前,不需打开胶塞,就可使装置中残留气体完全被吸收,应当采取的操作是?。
Ⅱ。饱和的NaHSO3溶液可以与醛发生加成反应,生成水溶性的α-羟基磺酸钠。发生的反应为:
R-CHO + NaHSO3 R-CH(OH)SO3Na
R-CH(OH)SO3Na
反应是可逆的,在通常条件下有70%--90%向正反应方向转化。
(4)利用Ⅰ中装置制取少量NaHSO3溶液,应采取措施,将装置进行部分改变。这种措施是:_____________________________________________________________________;确认有NaHSO3生成的现象是:_______________________________________.
(5)若溴苯中混有杂质乙醛,欲将此杂质除去,可采用的试剂是:__________,其分离的方法是:_____________________.
(6)若在CH3-CH(OH)SO3Na 水溶液中加入足量盐酸,有机物转化为:___________,将该转化产物分离出来的方法常用__________________.
参考答案:
(1)2H2SO4(浓)+Cu CuSO4+SO2↑+2H2O? (2分)
CuSO4+SO2↑+2H2O? (2分)
(2)试管A中气体压强减小,空气从D导管进入试管A中 (2分)
(3)从D管口向A中大量鼓气? (2分)
(4)将B和C的位置调换;(2分)品红溶液褪色。(2分)
(5)饱和NaHSO3溶液(2分)?分液(2分)?(6)CH3CHO(2分)蒸馏(2分)
本题解析:
(1)浓硫酸与铜反应,可参照课本浓硫酸的性质。
(2)D导管起到的作用是当A中的气压减小时,空气会由D导管进入A中,起到防止倒吸的作用。
(3)通过题目可知,从D管鼓气可以达到目的。
(4)要制备亚硫酸氢钠,就必需在氢氧化钠溶液中通入过量的二氧化硫,同时又要能验证出二氧化硫的已经过量,想到这里,将B与C两试管调换就可,当观察到品红溶液褪色时,说明二氧化硫已经过量,亚硫酸氢钠也就产生了。
(5)此小题是要结合信息,当然选用的是饱和亚硫酸氢钠溶液,除去了乙醛后属于互不相溶的液体,当采用分液的方法。
(6)根据题干中用亚硫酸氢钠除乙醛是一个可逆反应,当加入盐酸后,亚硫酸氢钠的浓度下降,平衡向逆反应方向移动,生成乙醛;因为乙醛溶在水溶液里,这时就要利用沸点不同,即蒸馏的方法。
本题难度:一般
5、计算题 两份不同浓度的NaOH溶液各500mL,分别吸收1120mL(标准状况下体积)SO2气体,反应后溶液中分别有5.75g和7.10g溶质。求两份NaOH溶液的物质的量浓度。
参考答案:0.150mol/L、0.240mol/L。
本题解析:解答本题时,一要挖掘隐含的两个反应;二要运用平均值规律通过对“5.75g”和“7.10g”的量的分析,判断溶质的组成。
SO2与NaOH作用可能的反应有:
SO2+2NaOH=Na2SO3+H2O;SO2+NaOH=NaHSO3。
1120mLSO2气体可生成0.0500molNa2SO3或NaHSO3,质量是6.30g或5.20g。依题意,两份溶液中,含溶质5.75g的一定含Na2SO3和NaHSO3;含溶质7.10g的一定含Na2SO3和NaOH。
设第一份溶液中含Na2SO3物质的量为x,NaHSO3物质的量为y,则:
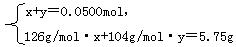
解得? x=0.0250mol,y=0.0250mol。
原溶液中含NaOH物质的量为:
2x+y=0.0750mol,
c(NaOH)=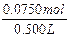 =0.150mol/L。
=0.150mol/L。
依上分析,第二份溶液中含Na2SO30.0500mol,质量是6.30g,则含NaOH的质量为:m(NaOH)=7.10g-6.30g=0.80g。
原溶液中含NaOH物质的量为:
2×0.0500mol+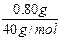 =0.120mol,
=0.120mol,
c(NaOH)=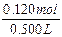 =0.240mol/L。
=0.240mol/L。
本题难度:简单