1、选择题 除去氯气中含有的少量水蒸气,所用试剂正确的是
A.固体氢氧化钠
B.生石灰
C.浓盐酸
D.浓硫酸
参考答案:D
本题解析:碱性干燥剂不能选用,会跟Cl2发生反应.浓盐酸无吸收性,只有浓硫酸可吸水又不与Cl2反应,故D对.
本题难度:简单
2、填空题 (10分)元素氯及其化合物在生产、生活、科研中有广泛的应用。
⑴25℃时,PbCl2固体在不同浓度盐酸(mol·L-1)中的溶解度(mmol·L-1)如图。
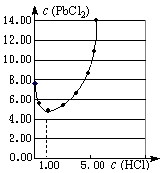
①在制备PbCl2的实验中,洗涤PbCl2固体最好选用?。
a.蒸馏水? b.1mol·L-1盐酸
c.5 mol·L-1盐酸? d.10mol·L-1盐酸
②当盐酸的浓度小于1mol·L-1时,随着盐酸浓度的增大,PbCl2 的溶解度减小,其原因是?。
⑵TCCA广泛用于漂白、杀菌消毒,其学名为三氯均三嗪-2,4,6-三酮,分子式为:C3Cl3N3O3。
①TCCA分子具有完全对称的结构,并含有一个六元环,则其结构简式为?。
②使用TCCA时,需先将该物质溶解于水,其水解产物之一为C3H3N3O3,另一种产
物具有强氧化性,能够杀菌消毒。写出另一种产物的电子式?。
⑶高氯酸铵(AP)作为一种优良的固体推进剂被用于导弹和火箭发射。目前,较为先进的制备方法是电解高纯次氯酸得到高纯高氯酸,再与高纯氨进行喷雾反应制成高氯酸铵。写出由次氯酸电解制备高氯酸的阳极反应式:?。
参考答案:⑴①b? ②Cl-浓度增大,PbCl2的溶解平衡逆向移动
⑵①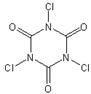 ?②
?②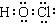
⑶①HClO+3H2O-6e-=ClO4—+7H+
本题解析:略
本题难度:一般
3、选择题 能证明碳酸的酸性比硅酸强的事实是
A.二氧化碳溶于水生成碳酸,二氧化硅不溶于水也不能跟水直接反应生成硅酸
B.在高温条件下,二氧化硅跟碳酸钠反应,生成硅酸钠和二氧化碳
C.二氧化硅的熔点比二氧化碳高
D.二氧化碳通入Na2SiO3稀溶液中,生成白色胶状沉淀
参考答案:D
本题解析:D选项是较强的酸与较弱酸的盐溶液反应生成较强酸的盐和较弱的酸的复分解反应,这是该类复分解反应发生的条件。B选项是酸性氧化物与盐反应,而不是酸与碱反应,并且它是在高温下进行的熔融反应,由于CO2气体逸出才使得此反应进行。这与我们平常讲的复分解反应条件不同。
本题难度:简单
4、选择题 下列说法正确的是(?)
A.红热的铜丝在Cl2中燃烧后生成蓝色的CuCl2
B.工业上将NH3与CO2在高温高压下制成[CO(NH2)2] 是氮的固定过程
C.SO3用98.3%的浓H2SO4吸收,目的是防止形成酸雾,以使SO3吸收完全
D.工业制取单质硅时会产生大量导致“温室效应”的气体
参考答案:C
本题解析:A.铜丝在Cl2中燃烧,生成的CuCl2为棕黄色,不正确
B.工业上将NH3与CO2在高温高压下制成[CO(NH2)2],并非氮的固定:单质氮气转化为化合态的过程,不正确
C.正确
D.工业制取单质硅:SiO2+2C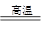 Si+2CO,不会产生大量导致“温室效应”的气体,排除
Si+2CO,不会产生大量导致“温室效应”的气体,排除
答案为C
本题难度:简单
5、选择题 下列关于氯水的说法正确的是
A.向氯水中通入少量二氧化硫,氯水的漂白性增强
B.氯水中加入NaCl固体,对溶液的pH无影响
C.常温下,pH=2的氯水中:c(Cl-)+c(ClO-)+c(OH-)=0.01mol/L
D.向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+2HCO3-=2CO2↑+Cl-+ClO-+H2O
参考答案:C
本题解析:A、向氯水中通入少量二氧化硫发生氧化还原反应生成盐酸和硫酸,氯水的漂白性减弱,A不正确;B、氯水中加入NaCl固体,溶液中氯离子浓度增大,则使平衡H2O+Cl2 H++Cl-+HClO向逆反应方向移动,所以溶液的pH增大,B不正确;C、常温下,pH=2的氯水中氢离子浓度是0.01mol/L,根据电荷守恒可知c(Cl-)+c(ClO-)+c(OH-)=c(H+)=0.01mol/L,C正确;D、次氯酸的酸性弱于碳酸的,因此向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+HCO3-=CO2↑+Cl-+HClO,D不正确,答案选C。
H++Cl-+HClO向逆反应方向移动,所以溶液的pH增大,B不正确;C、常温下,pH=2的氯水中氢离子浓度是0.01mol/L,根据电荷守恒可知c(Cl-)+c(ClO-)+c(OH-)=c(H+)=0.01mol/L,C正确;D、次氯酸的酸性弱于碳酸的,因此向氯水中滴加少量NaHCO3溶液的离子反应方程式为:Cl2+HCO3-=CO2↑+Cl-+HClO,D不正确,答案选C。
本题难度:一般