1、选择题 仅用下表提供的仪器(夹持仪器和试剂任选)不能实现相应实验目的的是
选项
| 实验目的
| 仪器
|
A
| 除去氢氧化铝胶体中的泥沙
| 漏斗(带滤纸)、烧杯、玻璃棒
|
B
| 从食盐水中获得NaCl晶体
| 坩埚、玻璃棒、酒精灯、泥三角
|
C
| 用0.10mol·L-1的盐酸测定未知浓度的NaOH溶液浓度
| 碱式滴定管、酸式滴定管、锥形瓶、胶
头滴管、烧杯
|
D
| 用MnO2和浓盐酸制取干燥、纯净
的Cl2
| 圆底烧瓶、分液漏斗、酒精灯、洗气瓶、
集气瓶、导管、石棉网
|
?
参考答案:B
本题解析:A、除去氢氧化铝胶体中的泥沙用过滤的方法,用所给仪器可以实现,错误;B、从食盐水中获得NaCl晶体用蒸发的方法,应用蒸发皿,题给仪器不能实现,正确;C、用0.10mol·L-1的盐酸测定未知浓度的NaOH溶液浓度用酸碱中和滴定的方法,所给仪器能实现,错误;D、用MnO2和浓盐酸制取干燥、纯净的Cl2,所给仪器能实现,错误。
本题难度:一般
2、选择题 下列实验的相关描述正确的是( )
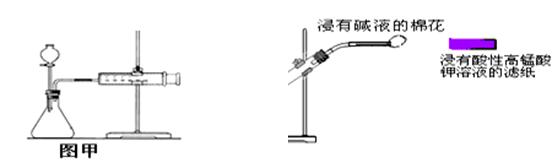
A.快速分离氢氧化铁胶状沉淀和氯化钠溶液可用抽滤法
B.常温下,苯酚与水形成的浊液静置后会分层,上层为溶有水的苯酚溶液
C.甲装置可用于某些化学反应速率的测定。该装置气密性的检查如下:仪器组装好后,关闭分液漏斗活塞,将针筒活塞向外拉一段距离后松手,观察针筒是否能回到原来刻度处
D.用氢氧化钠滴定醋酸实验,酸式滴定管没有润洗就直接使用则所得待测液浓度偏高
参考答案:C
本题解析:A.胶体可溶液均可穿过滤纸,故该选项错误;B.苯酚比水重,分层后下层为溶有水的苯酚溶液,该选项错误。C.考查该装置气密性检查方法,正确;D.用氢氧化钠滴定醋酸实验,酸式滴定管没有润洗就直接使用则所得待测液浓度偏低,该选项错误。
点评:实验是化学学习和应用的重要板块,实验现象和物质性质的相互结合和推断,是解本题的根本。本题考查学生对基础实验的掌握,难度一般。
本题难度:简单
3、选择题 下列与实验相关的叙述正确的是
A.稀释浓硫酸时,应将蒸馏水沿玻璃棒缓慢注入浓硫酸中
B.配制溶液时,若加水超过容量瓶刻度,应用胶头滴管将多余溶液吸出
C.酸碱滴定时,若加入待测液前用待测液润洗锥形瓶,将导致测定结果偏高
D.使用pH试纸测某溶液的pH时,应先将试纸润湿再测定
参考答案:C
本题解析:
分析:稀释硫酸的操作是“酸入水”,防止酸液飞溅;配制溶液时,如果加水超过容量瓶刻度,会导致溶液的浓度偏低,即使用胶头滴管吸出多余的水也不能改变溶液的浓度,正确的做法是重新配制;酸碱中和滴定时滴定管可用标准液或待测液润洗,否则会导致溶液浓度偏低,但锥形瓶不能用待测液润洗,会导致测定结果偏高;检验SO42-时,不能加入BaCl2溶液和稀盐酸,不能排除AgCl的干扰,应加入硝酸酸化的硝酸钡溶液.
解答:稀释硫酸的操作是将浓硫酸玻璃棒缓慢注入水中,否则会导致酸液飞溅,故A错;若将多余的水取出,会使得浓度偏小,加水超过容量瓶的刻度的唯一办法是重新配制,故B错;用待测液润洗锥形瓶,则消耗的标准液会偏多,导致结果偏高,故C正确;操作中,若溶液中含有Ag+,也会有不溶解于盐酸的白色沉淀产生,则溶液中不一定含有SO42-,故D错;故选:C.
点评:本题涉及到溶液的稀释、溶液的配制、酸碱中和滴定等实验基本操作以及离子的检验,难度不是很大,要注重基本实验操作的正确方法和相关注意事项;离子检验时要注意排除其它离子的干扰.
本题难度:一般
4、选择题 用已准确称量过的氯化钠固体配制1.00 mol·L-1的氯化钠溶液0.5 L,要用到的仪器是(? )
①500ml容量瓶? ②试管? ③烧瓶? ④胶头滴管? ⑤烧杯 ⑥玻璃棒 ⑦托盘天平 ⑧药匙
A.①②④⑤
B.①④⑤⑥
C.①④⑤⑥⑦⑧
D.全部
参考答案:B
本题解析:称量用到的实验仪器是:托盘天平、钥匙;配置溶液用到的实验仪器是:容量瓶、胶头滴管。故选B。
点评:本题考查了学生对基本实验操作的熟悉程度,题目较易,学生要掌握好基础的知识。
本题难度:一般
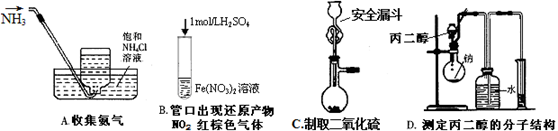
5、选择题 下列实验操作或现象分析正确的是?
参考答案:C
本题解析:A.NH3极容易溶解于水中,在常温下1体积的水能够溶解700体积的氨气,所以不能用排水法收集。错误。B.把1mol/L的硫酸滴加到Fe(NO3)2溶液中时就相当于FeSO4与HNO3的混合溶液。得到的硝酸浓度很小,稀硝酸发生氧化还原反应产生的NO为无色气体。错误。C.在实验室中是用70%的硫酸与Na2SO3反应来制取的。反应不用加热。正确。D.把丙二醇滴加到水中,由于醇羟基能与水发生置换反应产生氢气,所以可以根据该方法测定醇分子中的羟基的个数,但不能确定羟基的位置。错误。
本题难度:一般