1、简答题 用惰性电极分别电解下列物质的水溶液一段时间后,氢离子浓度不会改变的是( )
A.NaCl
B.CuSO4
C.AgNO3
D.Na2SO4
参考答案:A、用惰性电极电解氯化钠的水溶液,在阴极上放电的离子是电解质中的氢离子,氢离子浓度会减小,故A错误;
B、用惰性电极电解硫酸铜的水溶液,最后的生成物是铜、氧气和硫酸,氢离子浓度会增大,故B错误;
C、用惰性电极电解硝酸银的水溶液,最后的生成物是银、氧气和硝酸,氢离子浓度会增大,故C错误;
D、用惰性电极电解硫酸钠的水溶液,电解的实质是电解水,电解前后一直是硫酸钠的中性溶液,氢离子浓度不会改变,故D正确.
故选D.
本题解析:
本题难度:一般
2、选择题 一种充电电池放电时的电极反应为:H2+2OH--2e-=2H2O;NiO(OH)+H2O+e-=Ni(OH)2+OH- 当为电池充电时,与外电源正极连接的电极上发生的反应是
[? ]
A.H2O的还原
B.NiO(OH)的还原
C.H2的氧化
D.Ni(OH)2的氧化
参考答案:D
本题解析:
本题难度:一般
3、填空题 25.(12分)发展储氢技术是氢氧燃料电池推广应用的关键。研究表明液氨是一种良好的储氢物质,其储氢容量可达17.6% (质量分数)。液氨气化后分解产生的氢气可作为燃料供给氢氧燃料电池。氨气分解反应的热化学方程式如下:
2NH3(g)  N2 (g) + 3H2(g) ΔH =" +92.4" kJ·mol-1
N2 (g) + 3H2(g) ΔH =" +92.4" kJ·mol-1
请回答下列问题:
(1) 氨气自发分解的反应条件是 。(填“高温”、“低温”或“任何条件下”)
(2) 已知:2H2(g)+O2(g)=2H2O(g) ΔH =" -" 483.6 kJ·mol-1
NH3(l) NH3(g) ΔH =" +23.4" kJ·mol-1
NH3(g) ΔH =" +23.4" kJ·mol-1
则,反应4NH3(l)+3O2(g)=2N2(g)+6H2O(g)的ΔH = 。
(3) 研究表明金属催化剂可加速氨气的分解。图1为某温度下等质量的不同金属分别催化等浓度氨气分解生成氢气的初始速率。
①不同催化剂存在下,氨气分解反应的活化能最大的是 (填写催化剂的化学式)。
②恒温(T1)恒容时,用Ni催化分解初始浓度为c0的氨气,并实时监测分解过程中氨气的浓度。计算后得氨气的转化率α(NH3)随时间t变化的关系曲线(见图2)。请在图2中画出:在温度为T1,Ru催化分解初始浓度为c0的氨气过程中α(NH3) 随t变化的总趋势曲线(标注Ru-T1)。
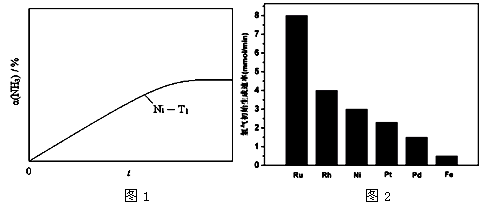
③如果将反应温度提高到T2,请在图2中再添加一条Ru催化分解初始浓度为c0的氨气过程中α(NH3) ~ t的总趋势曲线(标注Ru-T2)
(4) 用Pt电极对液氨进行电解也可产生H2和N2。阴极的电极反应式是 。
(已知:液氨中2NH3(l)  NH2- + NH4+)
NH2- + NH4+)
参考答案:(1) 高温
(2) -1172.4 kJ·mol-1
(3) ①Fe
② 见图曲线Ru-T1
③ 见图曲线 Ru-T2

(4) 2NH3 + 2e-= H2 + 2NH2- (或2NH4++2e-= H2 +2NH3)
本题解析:(1)高温有利于正反应的发生,可促进氨气的自发分解;(2)2NH3(g)  N2 (g) + 3H2(g);ΔH =" +92.4" kJ·mol-1①2H2(g)+O2(g)=2H2O(g);ΔH =" -" 483.6 kJ·mol-1②NH3(l)
N2 (g) + 3H2(g);ΔH =" +92.4" kJ·mol-1①2H2(g)+O2(g)=2H2O(g);ΔH =" -" 483.6 kJ·mol-1②NH3(l) NH3(g);ΔH =" +23.4" kJ·mol-1③;3×①+4×③-3×②="-1172.4" kJ·mol-1;(3)不同催化剂存在下,催化生成氢气的量越少,所需的活化能就越大;温度不变,使用Ru做催化剂,反应速度加快,但达到平衡时氨气的浓度相等;温度升高,使用同一种催化剂,反应速率加快,活化分子数增多,氨气的转化率增大;(4)阴极是得电子的反应,电解时氨气得电子。
NH3(g);ΔH =" +23.4" kJ·mol-1③;3×①+4×③-3×②="-1172.4" kJ·mol-1;(3)不同催化剂存在下,催化生成氢气的量越少,所需的活化能就越大;温度不变,使用Ru做催化剂,反应速度加快,但达到平衡时氨气的浓度相等;温度升高,使用同一种催化剂,反应速率加快,活化分子数增多,氨气的转化率增大;(4)阴极是得电子的反应,电解时氨气得电子。
考点:热化学方程式及相关计算、电极方程式的书写
点评:本题较有难度,关键是要掌握热化学方程式的计算和电极方程式的书写。
本题难度:困难
4、实验题 (6分)以电解食盐水为基础制取氯气等产品的工业称为“氯碱工业”,它是目前化学工业的重要支柱之一。
(1)电解饱和食盐水的化学方程式为?。
(2)常温下,某化学兴趣小组在实验室中,用石墨电极以右图装置进行电解某浓度氯化钠溶液的实验,电解一段时间后,收集到标准状况下氢气2. 24 L。(设电解前后溶液的体积均为1 L,不考虑水的蒸发或气体的溶解)(已知:lg5==0.70)
24 L。(设电解前后溶液的体积均为1 L,不考虑水的蒸发或气体的溶解)(已知:lg5==0.70)
①理论上,电解后溶液的pH=?。
②若实际测得反应后溶液的pH=13.00,则造成这种误差的原因可能是氯气和氢氧化钠溶液反应,写出该反应的离子方程式?。
参考答案:

本题解析:略
本题难度:一般
5、填空题 (14分)CuSO4溶液是中学化学及工农业生产中常见的一种试剂。
(1)配制CuSO4溶液时,需加入一定量的硫酸溶液,用离子方程式说明其原因是 。
(2)利用配制的CuSO4溶液及如图所示装置,进行以下实验探究。
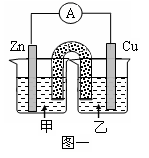
①图一是根据反应Zn+CuSO4 Cu+ZnSO4设计成的锌铜原电池。甲池中的电解质溶液为 (填化学式)______________,Cu极的电极反应式是__________________,盐桥中是含有琼胶的KCl饱和溶液,电 池工作时Cl-向________(填“甲”或“乙”)池移动。
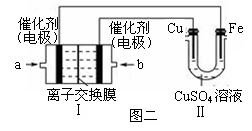
②图二中,Ⅰ是氢气燃料电池(电解质溶液为KOH溶液)的结构示意图,电池总反应为:2H2+O2=2H2O。该同学想在Ⅱ中实现铁上镀铜,则a处加入的是________(填“H2”或“O2”),b处电极上发生的电极反应式是_____________________。
③若把图二Ⅱ中电极均换为惰性电极且CuSO4溶液足量,电解时的化学反应方程式为 ,
一段时间后,反应停止。下列物质能使Ⅱ池恢复到反应前浓度的是________(填选项字母)。
A.Cu
B.CuO
C.CuCO3
D.Cu(OH)2