1、选择题 实验室常用硫酸铜溶液吸收气体中的硫化氢:CuSO4+H2S=CuS↓+H2SO4,该反应可以推测
A.CuS易水解
B.CuS可溶于盐酸
C.相同温度下氢硫酸饱和溶液中硫离子(S2-)浓度比CuS饱和溶液中大
D.强酸可以制取弱酸
参考答案:C
本题解析:根据沉淀转化以及溶度积常数的含义可知,该反应能够发生,这说明相同温度下氢硫酸饱和溶液中硫离子(S2-)浓度比CuS饱和溶液中大,从而可以生成硫化铜沉淀,答案选C。
点评:该题是高考中的常见题型,属于中等难度的试题。该题基础性强,侧重对学生解题能力的培养和训练,有利于培养学生的逻辑推理能力和应试能力。
本题难度:简单
2、选择题 在t℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。又知t℃时AgCl的Ksp=4×10-10。下列说法不正确的是(?)

A.在t℃时,AgBr的Ksp为4.9×10-13
B.在AgBr饱和溶液中加入NaBr固体,可使溶液由c点到b点
C.图中a点对应的是AgBr的不饱和溶液
D.在t℃时,AgCl(s)+Br-(aq) AgBr(s)+Cl-(aq)平衡常数K≈816
AgBr(s)+Cl-(aq)平衡常数K≈816
参考答案:B
本题解析:根据图中c点的c(Ag+)和c(Br-)可得,该温度下AgBr的Ksp为4.9×10-13,A正确;在AgBr饱和溶液中加入NaBr固体后,c(Br-)增大,沉淀溶解平衡逆向移动,c(Ag+)减小,平衡点仍在曲线上,B错误;在a点时Qc<Ksp,故为AgBr的不饱和溶液,C正确;选项D中K=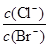 =
=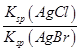 ,代入数据得K≈816,D正确。
,代入数据得K≈816,D正确。
本题难度:一般
3、选择题 把熟石灰放入蒸馏水中,一段时间后达到平衡,Ca(OH)2(s)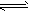 Ca2+(aq)+2OH-(aq),下列说法正确的是
Ca2+(aq)+2OH-(aq),下列说法正确的是
[? ]
A.给溶液加热,溶液的pH升高?
B.恒温下向溶液中加入CaO,溶液的pH升高
C.向溶液中加入Na2CO3溶液,Ca(OH)2固体其中质量增加
D.向溶液中加入少量NaOH固体,Ca(OH)2固体质量增加
参考答案:A
本题解析:
本题难度:一般
4、简答题 (16分)某煤渣主要含有Al2O3、SiO2,可制备碱式硫酸铝[Al2(SO4)3·2Al(OH)3]溶液,用于烟气脱硫,减少SO2的排放,其制备流程:
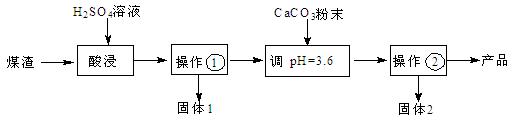
已知:25℃,Ksp(CaCO3)=2.8×10-9, Ksp(CaSO4)=9.1×10-6。
(1)操作①的名称 。
(2)酸浸时反应的离子方程式为 ;为了提高酸浸时铝元素的浸出率,可采取的措施____________________,___________________(写2条)。
(3)固体2的化学式是 ,试分析固体2生成的主要原因(用离子方程式结合文字简要说明) 。
(4)碱式硫酸铝溶液吸收SO2生成Al2(SO4)3·Al2(SO3)3,再向该溶液通入足量空气,生成一种硫酸盐,用于制备碱式硫酸铝溶液的循环使用,试写出有关反应的化学方程式: , 。
参考答案:(1)过滤(2分)
(2)Al2O3 + 6H+= 2Al3++ 3H2O (2分)
把煤渣粉碎,搅拌(使粉煤灰与硫酸溶液充分接触),适当延长酸浸的时间,增大硫酸浓度,升高温度(任答2条,每条1分,共2分,合理即给分)
(3)CaSO4(2分)
CaCO3+2H+=Ca2++H2O+CO2↑(1分),增大了Ca2+浓度(1分),使c(Ca2+)·c(SO42-)> Ksp(CaSO4)(1分),导致Ca2++SO42-= CaSO4↓(1分)
或:CaCO3+2H+=Ca2++H2O+CO2↑(1分),促进CaCO3(s)沉淀溶解平衡向溶解方向移动(1分),增大了Ca2+浓度,使c(Ca2+)·c(SO42-)> Ksp(CaSO4)(1分),促进CaSO4(s)沉淀溶解平衡向沉淀方向移动(1分)
(共4分,按要点给分,其他合理可给分)
(4)Al2(SO4)3·2Al(OH)3+3SO2=Al2(SO4)3·Al2(SO3)3 +3H2O (2分)
2Al2(SO4)3·Al2(SO3)3 + 3O2= 4Al2(SO4)3 (2分)
本题解析:煤渣主要含有Al2O3、SiO2,煤渣和稀硫酸混合,发生反应Al2O3+3H2SO4
本题难度:困难
5、选择题 已知CuSO4溶液分别与Na2CO3溶液、Na2S溶液的反应情况如下:
(1)CuSO4+Na2CO3
主要:Cu2++CO32-+H2O=Cu(OH)2↓+CO2↑
次要:Cu2++CO32-=CuCO3↓(几乎不发生反应。下同)
(2)CuSO4+Na2S
主要:Cu2++S2-=CuS↓
次要:Cu2++S2-+2H2O=Cu(OH)2↓+H2S↑
则下列几种物质的溶解度大小的比较中,正确的是(?)
A.CuS<Cu(OH)2<CuCO3
B.CuS>Cu(OH)2>CuCO3
C.Cu(OH)2>CuCO3>CuS
D.Cu(OH)2<CuCO3<CuS
参考答案:A
本题解析:先根据第一个反应对比Cu(OH)2与CuCO3溶解度的相对大小;再根据第二个反应对比Cu(OH)2和CuS溶解度的相对大小,最后综合比较。
本题难度:一般