1、填空题 水体中重金属铅的污染问题备受关注。水溶液中铅的存在形态主要有Pb2+、Pb(OH)+、Pb(OH)2、
Pb(OH)3-、Pb(OH)42-。各形态的浓度分数α随溶液pH 变化的关系如图所示:【图中1表示Pb2+,2表示
Pb(OH)+,3表示Pb(OH)2,4表示Pb(OH)3-,5表示Pb(OH)42-】

(l)Pb(NO3)2溶液中, ______2(填“>”、“=”或“<”);往该溶液中滴入氯化铵溶液后,
______2(填“>”、“=”或“<”);往该溶液中滴入氯化铵溶液后,
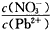 增加,可能的原因是___________________
增加,可能的原因是___________________
(2)往Pb(NO3)2溶液中滴稀NaOH溶液,pH=8时溶液中存在的阳离子(Na+除外)有___________,pH=9时,主要反应的离子方程式为_______________________。
(3)某课题组制备了一种新型脱铅剂,能有效去除水中的痕量铅,实验结果如下表:
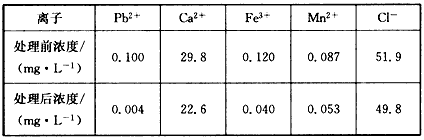
上表中除Pb2+外,该脱铅剂对其他离子的去除效果最好的是_________。
参考答案:(1)>;Pb2+与Cl-发生反应生成PdCl2沉淀,使c(Pb2+)减小
(2)Pb2+、Pb(OH)+、H+;Pb(OH)++OH-=Pb(OH)2↓
(3)Fe3+
本题解析:
本题难度:一般
2、选择题 下列说法正确的是?
A.根据Ksp(AgCl)=1.77×10-10mol2·L-2,Ksp(Ag2CrO4)=1.12×10-12mol3·L-3,可以推知AgCl的溶解度比Ag2CrO4的溶解度大
B.0.1mol·L-1的ZnCl2溶液中通入足量硫化氢气体最终得不到ZnS沉淀是因为溶液中c(Zn2+)·c(S2-)<Ksp(ZnS)
C.AgCl在10mL 0.01mol·L-1的KCl溶液中比在20mL0.05mol·L-1的AgNO3溶液中溶解的质量大
D.向碳酸钡沉淀中加入稀硫酸,沉淀发生转化,可推知硫酸钡的Ksp比碳酸钡的小
参考答案:BC
本题解析:略
本题难度:一般
3、选择题 温度不变时,向饱和BaSO4溶液中加水,下列叙述正确的是( )
A.BaSO4的溶解度不变,Ksp不变
B.BaSO4的溶解度减小,Ksp增大
C.BaSO4的溶解度不变,Ksp增大
D.BaSO4的溶解度增大,Ksp不变
参考答案:物质的溶解度是一定温度下的物理量,温度不变,物质溶解度不变,沉淀溶解平衡状态下的溶度积常数,随温度变化,不随浓度变化,一定温度下存在:Ksp=c(Ba2+)c(SO42-);
故选A.
本题解析:
本题难度:一般
4、填空题 (16分)请你利用所学反应原理知识解决下列问题:
(1)若已知两个反应:①C(s)+2H2(g)=CH4(g) ΔH1=" a" kJ·mol-1 ;
②C(s)+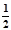 O2(g)=CO(g) ΔH2=" b" kJ·mol-1 ;
O2(g)=CO(g) ΔH2=" b" kJ·mol-1 ;
则2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH= (用含a、b的式子表示);
(2)碱性镁锰干电池是新开发的一种干电池,比普通锌锰干电池具有更加优越的性能,具有较大应用前景,其工作时总反应为:Mg+2MnO2+H2O=Mg(OH)2+Mn2O3;则工作时,正极发生 反应(填反应类型),写出负极的电极反应式: ;
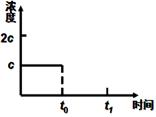
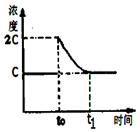
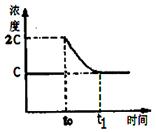
(3)在一定温度下1 L的密闭容器放入足量草酸钙(固体所占体积忽略不计)发生反应:CaC2O4(s) CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=;若某时刻达到平衡时c(CO2)= c;t0 时刻,将容器体积缩小为原来的一半并固定不变,在t1时刻再次达到平衡,请在下图中画出t0以后此体系中CO2的浓度随时间变化的图像;
CaO(s) +CO(g)+CO2(g),若前5 min 内生成CaO的质量为11.2 g ,则该段时间内v(CO)=;若某时刻达到平衡时c(CO2)= c;t0 时刻,将容器体积缩小为原来的一半并固定不变,在t1时刻再次达到平衡,请在下图中画出t0以后此体系中CO2的浓度随时间变化的图像;
(4)某温度下数据:草酸(H2C2O4)的K1=5.4×10-2,K2=5.4×10-5;醋酸的K=1.75×10-5;碳酸的 K1=4.2×10-7,K2=4.5×10-11;Ksp(CaC2O4) =5.0×10-9;Ksp(CaCO3) =2.5×10-9
①用醋酸溶液鉴别CaC2O4和CaCO3两种白色固体的实验现象是 ;
②向0.6 mol/L的Na2CO3溶液中加入足量 CaC2O4粉末后(忽略溶液体积变化),充分搅拌,发生反应:CO32-(aq) + CaC2O4(s)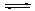 CaCO3(s)+ C2O42-(aq),静置后沉淀转化达到平衡,求此时溶液中的c(C2O42-)(不考虑其他诸如水解之类副反应,写出计算过程)。
CaCO3(s)+ C2O42-(aq),静置后沉淀转化达到平衡,求此时溶液中的c(C2O42-)(不考虑其他诸如水解之类副反应,写出计算过程)。
参考答案:(1)ΔH=2(b-a) kJ·mol¯1 (2分,); (2)还原 (2分); Mg+2OH——2e—=Mg(OH)2(2分)
(3)0.04 mol·L-1·min-1(2分);如右图所示(2分,起点2c,得1分;平衡点c,得1分)
(4)①一种固体溶解同时产生气泡逸出,另一种固体无现象(2分);
②解:该反应的K=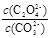 =
=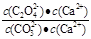 =
=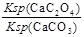 =
=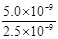 =2.0(2分),
=2.0(2分),
设c(CO32-)转化了x,则生成c(C2O42-)=x,剩余c(CO32-)=(0.6-x),
可得方程: x/(0.6-x) =2.0,解得x=0.4 mol·L¯1(2分)(无必要步骤,酌情扣分)。
本题解析:(1)将②×2-①×2可得2CH4(g)+O2(g)=2CO(g)+4H2(g) ΔH=2(b-a) kJ·mol¯1。(2)正极得到电子,发生还原反应;Mg做负极,反应后生成Mg(OH)2,负极的电极反应为:Mg+2OH——2e—=Mg(OH)2。(3)5 min 内生成CaO的质量为11.2 g 的物质的量为0.2mol,根据反应生成0.2mol的CaO同时生成0.2mol的CO,则v(CO)=" 0.2mol÷1L÷5" min=0.04mol·L-1·min-1。t0 时刻,将容器体积缩小为原来的一半并固定不变,则CO2的浓度变为2c,在t1时刻再达到平衡,CO2的浓度随时间变化的图像为:
(4)①从电离常数可以知道,HC2O4—>CH3COOH>H2CO3,醋酸溶液鉴别CaC2O4和CaCO3两种白色固体的实验现象是:一种固体溶解同时产生气泡逸出,另一种固体无现象
②解:该反应的K=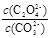 =
=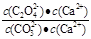 =
=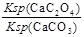 =
=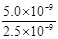 =2.0, 设c(CO32-)转化了x,则生成c(C2O42-)=x,剩余c(CO32-)=(0.6-x), 可得方程: x/(0.6-x) =2.0,解得x=0.4 mol·L¯1。
=2.0, 设c(CO32-)转化了x,则生成c(C2O42-)=x,剩余c(CO32-)=(0.6-x), 可得方程: x/(0.6-x) =2.0,解得x=0.4 mol·L¯1。
考点:盖斯定律的应用、化学反应速率的计算、化学图像的绘制、电离平衡常数和酸的强弱关系、电离平衡常数的有关计算。
本题难度:困难
5、选择题 向AgCl饱和溶液中加水,下列叙述正确的是 (? )
A.溶解度.Ksp均不变
B.溶解度.Ksp均变大
C.结晶过程停止,溶解过程加快
D.结晶过程将小于溶解过程,直至再达到平衡
参考答案:A
本题解析:在纯水中物质的溶解度和Ksp都只受物质性质和温度的影响,与其它外界条件无关,故A正确而B错误。沉淀的溶解平衡是和化学平衡一样的动态平衡,结晶过程和溶解过程都不会停止,而是结晶速率和溶解速率都改变。故C.D都不正确。
本题难度:一般