1、选择题 常温下,将等质量的铜片、银片、铁片、铝片分别置于四个小烧杯中,然后分别加足量的浓硝酸,放出
NO2气体最多的是
[? ]
A.铜片
B.银片
C.铁片
D.铝片
2、填空题 现在有一种含氧酸盐的固体试样,经测定,该固体含2种金属元素和两种非金属元素。其中酸根由一种金属元素和氧元素组成,且两种元素质量比为7:8。为进一步确定该固体成分,现将4.68 g该固体试样溶于水,滴加适量稀硫酸后,再加入2.24g铁粉,铁粉与酸根恰好完全反应生成Fe2+。向反应后的溶液中加入一定量的KOH溶液至刚好将Fe2+沉淀完全,过滤;将沉淀充分加热后得到Fe2O3 4.8 g。将滤液在一定条件下蒸发可得到一种纯净的不含结晶水的含氧酸正盐(不是复盐)A,测得其质量为13.92 g。
(1)A的化学式为_______________。
(2)该盐含有的金属元素是________________。
(3)通过计算推断该盐的化学式__________________。
3、填空题 白磷(P4)是磷的单质之一,易氧化,与卤素单质反应生成卤化磷。卤化磷通常有三卤化磷或五卤化磷,五卤化磷分子结构(以PC15为例)如下图所示。该结构中氯原子有两种不同位置。

(1)6.20 g白磷在足量氧气中完全燃烧生成氧化物,反应所消耗的氧气在标准状况下的体积为____L。
上述燃烧产物溶于水配成50.0 mL磷酸(H3PO4)溶液,该磷酸溶液的物质的量浓度为____ mol·L-1
(2)含0.300 mol H3PO4的水溶液滴加到含0.500 mol Ca(OH)2的悬浮液中,反应恰好完全,生成1种难溶盐和16.2 g H2O。该难溶盐的化学式可表示为____。
(3)白磷和氯、溴反应,生成混合卤化磷PCl5-xBrx(1≤x≤4,且x为整数)。如果某混合卤化磷共有3种不同结构(分子中溴原子位置不完全相同的结构),该混合卤化磷的相对分子质量为____。
(4)磷腈化合物含有3种元素,且分子中原子总数小于20。0.10 mol PCl5和0.10mol NH4Cl恰好完全反应,生成氯化氢和0.030 mol 磷腈化合物。推算磷腈化合物的相对分子质量(提示:M> 300)。
4、选择题 将2 molNaHCO3和一定量的Na2O2固体混合,在加热条件下让其充分反应后,对所得固体进行测定,发现Na2O2无剩余,则所得固体的物质的量(n)为
[? ]
A.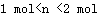
B.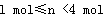
C.
D.
5、选择题 将足量的CO2不断通入KOH、Ba(OH)2、KAlO2的混合溶液中,生成沉淀与通入CO2的量的关系可表示为(已知Ba(AlO2):可溶)
[? ]
A.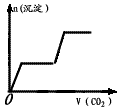
B.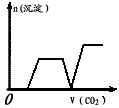
C.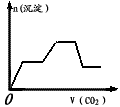
D.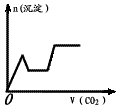
|