| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学试题《化学平衡》高频考点巩固(2019年模拟版)(十)
参考答案:D 本题解析:A.当X表示温度时,Y表示平衡常数K,该反应 ΔH=-746.8 kJ·mol-1,故升高温度,平衡向逆反应方向移动,平衡常数减小故A项错误;CO的转化率降低,故B项错误;N2的物质的量增大,平衡向逆反应方向移动,NO的转化率降低,故C项错误;该反应的平衡常数只与温度有关,一定温度下其它量发生变化,平衡常数不变,故D项正确。 本题难度:一般 3、选择题 已知某可逆反应:mA(g)+nB(g)?xC(g)△H=Q?kJ/mol,在密闭容器中进行如图表 |
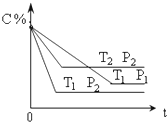
参考答案:C
本题解析:
本题难度:简单
4、填空题 (12分)已知反应2HI(g)  H2(g) +I2(g)在T℃下的平衡常数为0.01。T℃时,在容积为2L的密闭容器中加入HI,反应到某时刻测得各组分的浓度如下:
H2(g) +I2(g)在T℃下的平衡常数为0.01。T℃时,在容积为2L的密闭容器中加入HI,反应到某时刻测得各组分的浓度如下:
| 物质 | HI | H2 | I2 |
| 浓度/(mol·L-1) | 0.40 | 0.60 | 0.60 |
参考答案:21.(12分)(1)3.2mol(3分) (2)1.33 mol/L或1.34mol/L(3分)
(3)4/5或80%(3分) 11:14(3分)
本题解析:(1)利用三段式,2HI(g) H2(g)+ I2(g)
H2(g)+ I2(g)
开始浓度 1.6mol/L 0 0
转化浓度 1.2mol/L 0.60mol/L 0.60mol/L
某时刻浓度 0.40mol/L 0.60mol/L 0.60mol/L
平衡浓度 1.6-2x x x 起始加入HI的物质的量为1.6X2=3.2mol
(2)根据K=x2/(1.6-2x)2="0.01" 解得 x=2/15达到平衡后HI的物质的量浓度(1.6-4/15)÷2="1.33" mol/L;
(3)利用三段式,
2HI(g) H2(g)+ I2(g)
H2(g)+ I2(g)
开始浓度 0 a b
转化浓度 2x x x
平衡浓度 2x a-x b-x 解得(a-x)/(b-x)=1/4 (a-x)(b-x)/4x2=0.01,
解得a=11,b=14,平衡时HI的体积分数为80%,开始时H2(g)与I2(g)的体积比为11:14
考点:考查化学平衡的有关计算。
本题难度:一般
5、选择题 向盛有足量A的体积不变的密闭容器中通入B,发生反应:A(s)+2B(g) 4C(g)+D(g) △H>0,在一定温度、压强下达到平衡。平衡时C的物质的量与通入B的物质的量的变化关系如图所示。下列说法错误的是
4C(g)+D(g) △H>0,在一定温度、压强下达到平衡。平衡时C的物质的量与通入B的物质的量的变化关系如图所示。下列说法错误的是 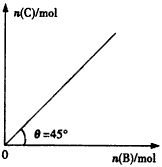
[? ]
A.混合气体的密度不再变化时,说明该反应达到平衡状态
B.该反应的平衡常数表达式为
C.若保持体积一定,当温度升高时,平衡常数增大,θ小于45°
D.该条件下,达到平衡时B的转化率为50%
参考答案:C
本题解析:
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《与量有关的.. | |