1、选择题
甲、乙、丙、丁四种易溶于水的物质,分别由NH4+、Ba2+、Mg2+、H+、OH-、Cl-、
HCO3-、SO42-中的不同阳离子和阴离子各一种组成。已知:
①将甲溶液分别与其他三种物质的溶液混合,均有白色沉淀生成;
②?0.1?mol/L乙溶液中c(H+)>0.1?mol/L;
③?向丙溶液中滴入AgNO3溶液有不溶于稀HNO3的白色沉淀生成。下列结论不正确的是
[? ]
A.甲溶液含有Ba2+
B.乙溶液含有SO42-
C.丙溶液含有Cl-?
D.丁溶液含有Mg2+
参考答案:D
本题解析:
本题难度:一般
2、选择题 下列解释实验现象的反应方程式正确的是? ( )
A.切开的金属Na暴露在空气中,光亮表面逐渐变暗2Na+O2=Na2O2
B.向AgCl悬浊液中滴加Na2S溶液,白色沉淀变成黑色2AgCl+S2-=Ag2S↓+2Cl-
C.Na2O2在潮湿的空气中放置一段时间,变成白色粘稠物2Na2O2+2CO2=2Na2CO3+O2
D.向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O
参考答案:B
本题解析:A项,切开的金属钠暴露在空气中,光亮表面变暗的原因是钠被氧化生成Na2O,反应方程式为4Na+O2=2Na2O,故A错误;C项,Na2O2放置在潮湿的空气中发生的反应有2Na2O2+2CO2=2Na2CO3+O2和2Na2O2+2H2O=4NaOH+O2↑,故C错误;D项,向NaHCO3溶液中加入过量的澄清石灰水,出现白色沉淀的反应方程式为HCO3-+Ca2++OH-=CaCO3↓+H2O,故D错误。
本题难度:简单
3、选择题 下列各离子组的叙述正确的是
A.在强酸性条件下Na+、IO-、K+、可以大量共存
B.在强碱性条件下K+、AlO2-、Na+、NO3—可以大量共存
C.在水溶液中H+、NH4+、SiO32—、Cl-不能大量共存
D.在强酸性条件下NH4+、K+、SO32—、S2-可以大量共存
参考答案:B
本题解析:
本题难度:困难
4、选择题 下列物质中能导电且属于电解质的是:
A.硝酸钾溶液
B.蔗糖
C.金属铜
D.熔融的氯化钠
参考答案:D
本题解析:
本题难度:一般
5、选择题 往含0.2molNaOH和0.1molCa(OH)2的溶液中持续稳定地通入CO2气体,当通入气体为6.72L(S.T.P)时立即停止,则这一过程中,溶液中离子的物质的量和通入CO2气体的体积关系正确的图象是(气体的溶解忽略不计)( )
A.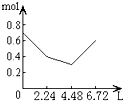
B.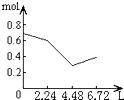
C.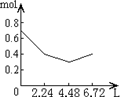
D.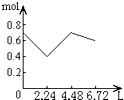
参考答案:n(CO2)=6.72L22.4L/mol=0.3mol,
含有0.2mol氢氧化钠和0.1mol氢氧化钙的溶液中:n(OH-)=0.2mol+0.1mol×2=0.4mol,n(Na+)=0.2mol,
n(Ca2+)=0.1mol,
通入CO2,发生:2OH-+CO2=CO32-+H2O,OH-+CO2=HCO3-+H2O,Ca2++CO32-=CaCO3↓,
设生成xmolCO32-,ymolHCO3-,
则 2x+y=0.4x+y=0.3x=0.1,y=0.2,
所以反应后溶液中含有:n(Na+)=0.2mol,n(HCO3-)=0.2mol,
可依次发生:①2OH-+CO2=CO32-+H2O,
②Ca2++CO32-=CaCO3↓,离子浓度迅速减小,
③OH-+CO2=HCO3-,
所以图象C符合,
故选:C.
本题解析:
本题难度:简单