1、填空题 下图为一定量的饱和Ca(OH)2澄清溶液中通入二氧化碳气体后,产生碳酸钙白色沉淀的质量与通入二氧化碳气体体积的关系曲线,请回答下列问题

(1)写出O-A段曲线与A-B段曲线所表现的离子方程式:
OA:___________________, AB:___________________;
(2)A点处,参加反应的二氧化碳与氢氧化钙的物质的量之比为:____________;
(3)B点处,溶液中存在离子的浓度最大的两种离子是:___________________。
参考答案:(1)Ca2++2OH-+CO2==CaCO3↓+H2O;CaCO3+CO2+H2O==Ca2++2HCO3-
(2)1:1
(3)Ca2+;HCO3-
本题解析:
本题难度:一般
2、选择题 下列离子方程式中,正确的是
A.把金属铁放入稀硫酸中:2Fe+6H+=2Fe3++3H2↑
B.碳酸钡和稀硫酸反应:BaCO3+2H+=Ca2+CO2↑+H2O
C.澄清石灰水和盐酸反应:H++OH-=H2O
D.向CuSO4溶液中加入适量Ba(OH)2溶液:Ba2++SO42-=BaSO4↓
参考答案:C
本题解析:
本题难度:一般
3、填空题 目前,新能源不断被利用到现代的汽车中,高铁电池技术就是科研机构着力研究的一个方向。
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,则该种电池负极材料是?。
(2)工业上常采用NaClO氧化法生产高铁酸钾(K2FeO4),K2FeO4在碱性环境中稳定,在中兴和酸性条件下不稳定。反应原理为:
Ⅰ在碱性条件下,利用NaClO氧化Fe(NO3)3制得Na2FeO4
3NaClO + 2Fe(NO3)3 + 10NaOH=2Na2FeO4↓+ 3NaCl + 6NaNO3 + 5H2O
Ⅱ Na2FeO4与KOH反应生成K2FeO4:Na2FeO4 + 2KOH=K2FeO4 + 2NaOH
主要的生产流程如下:

①写出反应①的离子方程式?。
②流程图中“转化”(反应③)是在某低温下进行的,说明此温度下Ksp(K2FeO4)?Ksp(Na2FeO4)(填“>”或“<”或“=”)。
(3)已知K2FeO4在水溶液中可以发生:4FeO42—+10H2O 4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是?。
4Fe(OH)3↓+8OH—+3O2↑,则K2FeO4可以在水处理中的作用是?。
(4)FeO42—在水溶液中的存在形态图如图所示。
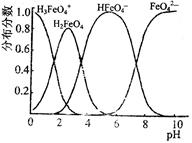
①若向pH=10的这种溶液中加硫酸至pH=2,HFeO4-的分布分数的变化情况是?。
②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中,?转化为?(填化学式)。
参考答案:
(1)Zn(1分);
(2)①Cl2+2OH—=Cl—+ClO—+H2O(2分)②<(2分);
(3)杀菌消毒(1分),净化(1分);
(4)①先变大,后变小(2分)②HFeO4-转化为FeO42—(2分)。
本题解析:
(1)高铁酸钾-锌电池(碱性介质)是一种典型的高铁电池,根据电池的形成条件,其中高铁酸钾为正极材料得电子;负极失电子的是锌,故电池负极材料是Zn;
(2)①分析反应①是将氯气通入到氢氧化钠溶液中,其离子方程式为:Cl2+2OH—=Cl—+ClO—+H2O;②反应③是:Na2FeO4 + 2KOH=K2FeO4 + 2NaOH,其能在某低温下进行的,说明此温度下Ksp(K2FeO4)<Ksp(Na2FeO4);
(3)由于K2FeO4在水溶液中可以发生:4FeO42—+10H2O 4Fe(OH)3↓+8OH—+3O2↑,故K2FeO4在水处理中起到了杀菌消毒的作用;生成的胶状氢氧化铁还有净化作用;
4Fe(OH)3↓+8OH—+3O2↑,故K2FeO4在水处理中起到了杀菌消毒的作用;生成的胶状氢氧化铁还有净化作用;
(4)①分析FeO42—在水溶液中的存在形态图,可知在pH由10变化到2时,HFeO4-的分布分数是先变大,后变小;②若向pH=6的这种溶液中滴加KOH溶液,则溶液中含铁元素的微粒中HFeO4-转化为FeO42—。
本题难度:困难
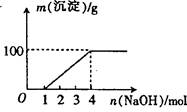
4、选择题 某澄清透明溶液中只可能含有①Al3+;② Mg2+;③Fe3+;④Fe2+;⑤H+;⑥CO32+;⑦NO3-中的几种,向该溶液中逐滴加入NaOH溶液至过量,生成沉淀的质量与NaOH的物质的量的关系如图所示。则该溶液中一定含有的离子是:(?)
A.②⑤⑥⑦
B.②③⑤⑦
C.①②③⑥⑦
D.①②③④⑤⑦
参考答案:B
本题解析:向该溶液中加入NaOH溶液的过程中,开始没有沉淀,说明溶液呈酸性,则一定含有大量的H+离子,在酸性溶液中CO32-离子与H+离子反应生成CO2气体而不能存在,根据溶液的电中性可知一定含有阴离子,则一定含有NO3-离子;而后才有沉淀,能够生成沉淀的是Fe3+、Fe2+或Al3+或Mg2+中的一种或几种,但在酸性条件下Fe2+离子与NO3-离子发生氧化还原反应而不能共存,则一定不含Fe2+离子,沉淀达最大量后继续滴加NaOH溶液沉淀不减少消失.说明一定不含有Al3+;在NaOH溶液为4mol时,若沉淀全部是Mg(OH)2质量为87g,若全部为氢氧化铁则质量为107g,根据图像可知沉淀完全是质量为100g,说明溶液一定是含有②Mg2+;③Fe3,综上所述,溶液中一定含有H+离子、NO3-离子,一定没有AlO2-、CO32-、Fe2+离子,一定含有Fe3+、Mg2+;
本题难度:一般
5、选择题 限用硝酸、硫酸、盐酸、醋酸、钠盐、钾盐、钡盐相互反应符合离子方程式2H++SO32-=H2O+SO2的化学方程式个数有
A.4
B.6
C.8
D.12
参考答案:A
本题解析:
本题难度:一般