1、选择题 下列叙述正确的是( )
A.在原电池的负极和电解池的阴极上都发生氧化反应
B.用惰性电极电解CuSO4溶液,阴阳两极产物的物质的量之比为1:2
C.依据导电能力的大小,把电解质分为强电解质和弱电解质
D.水溶液导电的过程就是电解过程,是化学变化
参考答案:A、电解池阴极上得电子发生还原反应,故A错误;
B、用惰性电极电解硫酸铜溶液时,阴极上析出铜,阳极上析出氧气,根据2Cu2++4e-=2Cu,4OH--4e-=O2↑+2H2O知,阴阳两极产物的物质的量之比为2:1,故B错误;
C、电解质的强弱是根据电解质的电离程度划分的,与溶液的导电能力大小无关,强酸、强碱和大部分盐属于强电解质,故C错误;
D、水溶液导电是阴阳离子在两个电极发生的氧化还原反应,属于化学变化,故D正确.
故选D.
本题解析:
本题难度:简单
2、填空题 (1)下列装置属于原电池的是_________;?

(2)在选出的原电池中,______?是负极,发生______?反应?,______?是正极?,该极的现象________________;
(3)此原电池反应的化学方程式为___________________________。
参考答案:(1)?⑤?
(2)?Fe?;氧化?;Cu?;有气泡产生?
(3)?Fe+H2SO4=?FeSO4+?H2?↑
本题解析:
本题难度:一般
3、填空题 (13分)铁及铁的化合物应用广泛,如FeCl3可用作催化剂、印刷电路铜板腐蚀剂和外伤止血剂等。
(1)写出FeCl3溶液腐蚀印刷电路铜板的离子方程式: _______________________________
(2)若将(1)中的反应设计成原电池,请在方框内画出原电池的装置图,标出正、负极及材料、电解质溶液并写出电极反应式。

正极反应____________________________;
负极反应____________________________。
(3)氢氧燃料电池是符合绿色化学理念的新型发电装置。下图为电池示意图,该电池电极表面镀一层细小的铂粉,铂吸附气体的能力强,性质稳定。请回答下列问题:

①负极反应式为 溶液PH (填“增大”、“不变”或“减小”)。
②该电池工作时,H2和O2连续由外部供给,电池可连续不断提供电能。因此,大量安全储氢是关键技术之一。金属锂是一种重要的储氢材料,吸氢和放氢原理如下:
Ⅰ.2Li+H2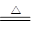 2LiH Ⅱ.LiH+H2O=LiOH+H2↑
2LiH Ⅱ.LiH+H2O=LiOH+H2↑
反应Ⅰ中的还原剂是 ,7 gLi可吸收标况下H2 L,此时转移电子 moL。
参考答案:(1)2Fe3+ + Cu = 2Fe2+ + Cu2+
(2)2Fe3+ + 2e-= 2Fe2+ ;Cu - 2e-= Cu2+ 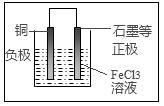
(3)①2H2 - 4e- + 4OH—= 4H2O;减小 ②Li;11.2;1
本题解析:(1)FeCl3溶液腐蚀印刷电路铜板的离子方程式是2Fe3+ + Cu = 2Fe2+ + Cu2+(2)若将(1)中的反应设计成原电池,则Cu作负极,活动性比Cu弱的金属或石墨作正极,含有Fe3+离子的溶液作电解质溶液,装置图是 ;正极反应是2Fe3+ + 2e-= 2Fe2+ ;负极反应是Cu - 2e-= Cu2+;(3)①在氢氧燃料电池中,通入燃料的电极是负极,负极反应式为2H2 - 4e- + 4OH—= 4H2O;通入氧气的电极是正极,正极的电极反应式是:O2 + 4e- + 2H2O = 4OH— ;由于不断消耗氢氧根离子,所以溶液的pH逐渐减小;②在反应Ⅰ中的还原剂是Li;7 gLi的物质的量是1mol,根据反应方程式可知反应消耗0.5mol的氢气,其在标况下的体积是11.2L。由于Li是+1价的金属,所以此时转移电子是1mol。
;正极反应是2Fe3+ + 2e-= 2Fe2+ ;负极反应是Cu - 2e-= Cu2+;(3)①在氢氧燃料电池中,通入燃料的电极是负极,负极反应式为2H2 - 4e- + 4OH—= 4H2O;通入氧气的电极是正极,正极的电极反应式是:O2 + 4e- + 2H2O = 4OH— ;由于不断消耗氢氧根离子,所以溶液的pH逐渐减小;②在反应Ⅰ中的还原剂是Li;7 gLi的物质的量是1mol,根据反应方程式可知反应消耗0.5mol的氢气,其在标况下的体积是11.2L。由于Li是+1价的金属,所以此时转移电子是1mol。
考点:考查原电池的反应原理、电极反应式的书写及电子转移的知识。
本题难度:一般
4、选择题 过量的两份锌粉a和b,分别加入等量的稀硫酸中,并向a中加入少量CuSO4溶液,下图表示产生H2的体积(V)与时间(t)的关系正确的是( ) 
参考答案:C
本题解析:锌能和硫酸铜反应置换出铜,从而构成铜锌原电池,加快反应速率,即a中曲线的斜率大。由于锌是过量的,则生成的氢气是等量的,所以选项C正确,答案选C。
考点:考查原电池的应用、外界条件对反应速率的影响
点评:该题是中等难度的试题,主要是考查学生灵活运用基础知识解决实际问题的能力的培养,有利于培养学生的逻辑推理能力。该题的关键是明确外界条件是如何影响反应速率的,如何结合图像灵活运用即可。
本题难度:一般
5、选择题 如图甲把锌片和铜片用导线相连后插入稀硫酸溶液构成原电池。某实验兴趣小组做完实验后,在读书卡上的记录如图乙所示,则卡片上的描述合理的是
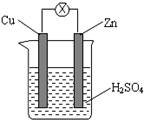

图甲 图乙
A.①②③
B.②④
C.④⑤⑥
D.③④⑤