1、选择题 某原电池反应的离子方程式为Fe+2H+=Fe2++H2↑,则下列说法正确的是
[? ]
A.HNO3为电解质溶液
B.锌为原电池正极
C.铁极质量不变
D.铜为原电池正极
2、选择题 一学生欲通过实验判断X,Y,Z,W四块金属的活泼性, 做了如下实验并得结论:当X,Y组成原电池时,Y为负极;当Z,W组成原电池时,W为正极;W能将Y从其盐溶液中置换出来,据此可知它们的活泼性顺序是
[? ]
A.Z>W> X>Y
B.X>Y>Z>W
C.X>Y>W>Z
D.Z>W> Y>X
3、选择题 按下图装置实验,若x轴表示流入正极的电子的物质的量,则y轴应表示(忽略溶液体积的变化)
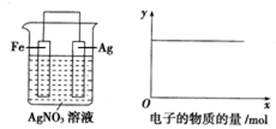
A.c(Ag+)
B.c(NO3?)
C.Ag棒的质量
D.溶液的质量
4、选择题 已知Fe2+可用K3Fe(CN)6来检验(呈蓝色).将图I装置中的铁棒末段分别联上一块锌片和铜片,并静置于含有K3Fe(CN)6及酚酞的混合凝胶上.一段时间后发现凝胶的某些区域(如图II示)发生了变化.则下列说法正确的是( )
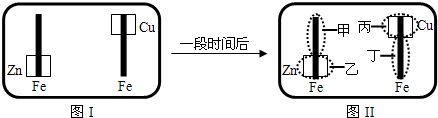
A.甲区不变色
B.乙区呈现蓝色
C.丙区产生Cu2+离子
D.丁区产生Fe2+离子
5、选择题 把a、b、c、d四块金属片浸在稀硫酸中,用导线两两连接可以组成原电池,若a、b相连时a为负极;a、c相连时c极上产生大量气泡;b、d相连时b为正极;c、d相连时,电流由d到c。则这四种金属的活动性顺序由大到小为
[? ]
A.a>c>d>b
B.a>b>c>d
C.c>a>b>d
D.b>d>c>a