1、选择题 已知镁跟稀硝酸反应时,每有1molHNO3反应,就有0.8mol电子转移,此时HNO3的还原产物是
A.NO2
B.NO
C.N2O
D.NH4NO3
参考答案:CD
本题解析:分析:根据Mg和硝酸反应生成硝酸镁和还原产物、水,由0.8mol电子转移可计算Mg的物质的量,进一步计算作氧化剂的硝酸的物质的量,最后利用电子守恒计算HNO3的还原产物N元素的化合价,从而确定答案.
解答:Mg和硝酸反应生成硝酸镁和还原产物、水,
Mg元素的化合价由0升高到+2,
反应中有0.8mol电子转移,
则n(Mg)=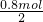 =0.4mol,
=0.4mol,
由Mg~Mg(NO3)2可知,作酸性的硝酸为0.4mol×2=0.8mol,
所以作氧化剂的硝酸为1mol-0.8mol=0.2mol,
设HNO3的还原产物中N元素的化合价为x,由电子守恒可知,
0.8mol=0.2mol×(5-x),
解得x=+1,
显然选项C、D中N元素的化合价符合题意,
故选CD.
点评:本题考查氧化还原反应及硝酸的性质,明确发生的化学反应,利用原子守恒、电子守恒即可解答,难度不大,选项D为学生解答中的难点和易错点.
本题难度:困难
2、选择题 最新的研究表明:一氧化氮吸入治疗法可快速改善SARS重症患者的缺氧状况,缓解病情。病毒学研究同时证实,一氧化氮对SARS病毒有直接抑制作用。下列关于一氧化氮的叙述正确的是?
[? ]
A.一氧化氮是一种红棕色的气体
B.常温常压下,一氧化氮不能与空气中的氧气直接化合
C.含等质量氧元素的一氧化氮与一氧化碳的物质的量相等
D.一氧化氮易溶于水,不能用排水法收集
参考答案:C
本题解析:
本题难度:简单
3、选择题 如图,在25℃,101.3KPa下,将10mLO2全部压入左端盛有20mLN0的注射器中充分反应.以下对压入O2后左端注射器中的气体描述错误的是( )
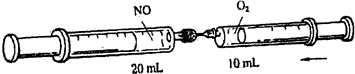
A.气体变为红棕色
B.气体体积仍为20mL
C.气体变为混合物
D.气体中氮与氧元素的物质的量之比等于1:2
参考答案:B
本题解析:
本题难度:简单
4、选择题 某试管中盛装的是红棕色气体(可能是两种气体的混合物),当倒扣在盛水的水槽中时,试管内水面上升,但不能充满试管。当试管内鼓入氧气后,可以观察到试管中水柱继续上升,经多次重复后,试管内完全被水充满,则原来试管中盛装的气体是
[ ? ]
A.一定是O2与NO2的混合气体
B.可能是NO和NO2的混合气体
C.可能是N2与NO2的混合气体
D.只可能是NO2一种气体
参考答案:B
本题解析:
本题难度:一般
5、选择题 发射“神六”的运载火箭,其推进剂引燃后发生剧烈反应,产生大量高温无色气体(CO2、H2O、N2、
NO)从火箭尾部喷出。但在发射现场看到火箭尾部喷出大量棕红色的气体,产生棕红色气体的可能原因是
[? ]
A.NO遇空气生成NO2
B.高温下N2遇空气生成NO2
C.CO2与N2反应生成CO和NO2
D.NO和H2O反应生成H2和NO2
参考答案:A
本题解析:
本题难度:简单