1、选择题 对氧化铝的分类中正确的是
A.酸性氧化物
B.碱性氧化物
C.两性氧化物
D.不成盐氧化物(像CO一样)
参考答案:C
本题解析:由于氧化铝既能与酸反应产生盐和水,又能与碱反应产生盐和水,所以氧化铝属于两性氧化物。
本题难度:简单
2、选择题 生活离不开化学,下列做法不合适的是( )
A.用铝锅长时间存放剩菜
B.用白醋清洗热水瓶中的水垢
C.用碘水检测土豆中含有淀粉
D.利用激光笔区别鸡蛋清和浓盐水
参考答案:A、铝表面生成氧化铝薄膜不溶于水,但却能溶解于酸性或碱性溶液中,用铝锅长时间存放剩菜,不仅会毁坏铝锅,而且汤菜里会有较多的铝,对人体有害,故A错误;
B、水垢的主要成分为碳酸钙、氢氧化镁等,可以与醋酸反应生成可溶性的醋酸盐,故B正确;
C、淀粉遇碘变蓝色,可以碘水检测土豆中含有淀粉,故C正确;
D、鸡蛋清属于胶体,具有丁达尔效应,浓盐水属于溶液,没有丁达尔效应,故可以用激光笔照射区别,故D正确;
故选A.
本题解析:
本题难度:一般
3、选择题 Al和Al2O3的混合物15g,加入稀H2SO4150mL,在标准状况下放出氢气1.68L,Al和Al2O3均不剩余,为中和过量的硫酸,并使溶液中Al3+恰好完全转化为Al(OH)3沉淀,需要消耗3mol·L-1NaOH溶液200mL,则该稀硫酸的物质的量浓度为(?)
A.2.25 mol·L-1
B.2 mol·L-1
C.0.3 mol·L-1
D.0.6 mol·L-1
参考答案:B
本题解析:
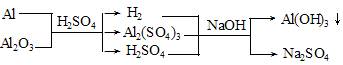
根据最终溶液中的电荷守恒和化学反应中的质量守恒可得:
n(H2SO4)=n(Na2SO4)=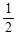 n(NaOH)=
n(NaOH)=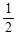 ×3mol·
×3mol·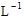 ×0.2L=0.3 mol
×0.2L=0.3 mol
所以c(H2SO4)=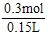 =2 mol·L-1。
=2 mol·L-1。
本题难度:简单
4、选择题 往硝酸银、硝酸镁、硝酸铜的混合溶液中加入一定量铁粉,充分反应后,再过滤.下列情况不可能存在的是
A.滤纸上有Ag、Cu,滤液中有Ag+、Fe2+、Mg2+
B.滤纸上有Ag,滤液中有Ag+、Cu2+、Fe2+、Mg2+
C.滤纸上有Ag、Cu,滤液中有Fe2+、Mg2+
D.滤纸上有Ag、Cu、Fe,滤液中有Fe2+、Mg2+
参考答案:A
本题解析:分析:氧化性:Ag+>Cu2+>Fe2+>Mg2+,在金属活动性顺序中,Mg>Fe>Cu>Ag,位置在前的金属能将位于其后的金属从其盐溶液中置换出来,AgNO3、Cu(NO3)2、Mg(NO3)2 的混合溶液中加入一些铁粉,Mg>Fe>Cu>Ag,铁不会与硝酸镁反应,故滤液中一定含有硝酸镁,铁与硝酸银反应生成硝酸亚铁和银,铁与硝酸铜反应生成硝酸亚铁和铜,生成的铜与硝酸银能反应生成硝酸铜和银.
解答:A.在硝酸银与硝酸铜同时存在时,Fe先与硝酸银充分反应后再与硝酸铜反应,当滤纸上有Cu时,说明硝酸银全部参加了反应.因此滤液中一定没有硝酸银,即溶液中一定不存在Ag+,故A错误;
B.当铁粉量不足时,只与部分硝酸银反应,生成银,仍有硝酸银剩余,由于氧化性:Ag+>Cu2+>Fe2+>Mg2+,则滤液中有
Ag+、Cu2+、Fe2+、Mg2+,故B正确;
C.当铁粉适量时,能与混合液中的硝酸银和硝酸铜恰好完全反应,生成Ag和Cu,滤液中有Fe2+、Mg2+,故C正确;
D.当铁粉过量时,与混合液中的硝酸银和硝酸铜完全反应,生成Ag和Cu,Fe有剩余,滤液中有Fe2+、Mg2+,故D正确.
故选A.
点评:本题考查了金属活动性顺序的应用,完成此题,可以依据金属活动性顺序的意义进行,注意离子的氧化性,判断离子反应的先后顺序.
本题难度:一般
5、选择题 下列有关金属及其合金的说法不正确的是( )
A.目前我国流通的硬币是由铁、铜、铝的合金材料制造的
B.铝在氧气中燃烧放出大量的热和耀眼的白光
C.铝热反应可用于焊接钢轨
D.铝锅表面有致密的氧化膜保护,可以蒸煮碱性食物
参考答案:D
本题解析:D、铝锅表面有致密的氧化膜为氧化铝,氧化铝为两性氧化物,既可以与酸反应也可以与碱反应,故错。故选D。
点评:本考点主要考查纯金属与合金的性质,金属的三个化学性质要记牢.合金概念的三个特点要记牢,还要理解合金的性质,即合金的硬度大,熔点低、耐腐蚀.本考点基础性强,比较好把握。
本题难度:一般