1、填空题 写出铝与稀盐酸、氢氧化钠溶液反应的化学方程式:________________________; _________________________。
参考答案:2Al+6HCl=2AlCl3+3H2↑;2Al+2NaOH+2H2O=2NaAlO2+3H2↑
本题解析:
本题难度:一般
2、选择题 将三份质量相同的镁粉分别放在下列物质中完全燃烧,所得固体质量最大的是(?)
1.纯氧? 2.空气? 3.二氧化碳
A.1
B.2
C.3
D.无法判断
参考答案:C
本题解析:镁与上述气体反应生成的固体分别为MgO,Mg3N2、MgO、C,MgO、C,根据Mg守恒可知3的质量大于1,2中主要产物之一的Mg3N2,其质量小于含等量Mg的MgO,故答案为C。
本题难度:简单
3、填空题 烧结法制氧化铝生产过程如下:
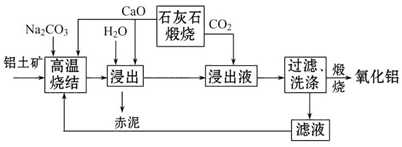
已知:
①铝土矿主要成分为:Al2O3、SiO2、Fe2O3和TiO2。
②高温烧结时,Al2O3、Fe2O3、TiO2都能发生反应分别生成NaAlO2、Na2Fe2O4和难溶于水的CaTiO3。
请回答下列问题:
(1)Na2Fe2O4遇水便发生水解反应生成Fe(OH)3,写出Na2Fe2O4水解的化学方程式____________。
(2)浸出时再加入CaO的目的是______________________________________。
(3)浸出液中发生的生成Al(OH)3的离子方程式为____________________________________。
(4)滤液的主要成分是_________(写化学式);滤液循环使用的优点有________ (任答一点)。
参考答案:(1)Na2Fe2O4+4H2O=2NaOH+2Fe(OH)3↓
(2)除去可能溶于水的硅酸盐,提高氧化铝纯度
(3)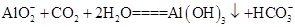
(4)NaHCO3、Ca(HCO3)2?减少工业废水排放或节约原料,降低成本(其他合理答案也可)
本题解析:(1)由题设知,Na2Fe2O4和水是反应物,Fe(OH)3是生成物,则Na2Fe2O4水解反应的化学方程式为:Na2Fe2O4+4H2O=2NaOH+2Fe(OH)3↓。
(2)由于浸出液中可能还含有可溶性硅酸盐,再加入CaO的目的是:除去可能溶于水的硅酸盐,提高氧化铝纯度。
(3)由于浸出液的主要成分是NaAlO2,通入过量CO2气体发生反应的离子方程式为: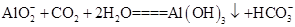 。
。
(4)滤液的主要成分为:NaHCO3和Ca(HCO3)2,滤液循环使用的优点有:①减少工业废水排放;②节约原料,降低成本等。
本题难度:一般
4、填空题 铝热反应实验如下:用两张圆形滤纸分别折叠成漏斗状,套在一起(先将置于内层的漏斗底部剪一个小孔,用水润湿),架在铁架台 的铁圈上,下面放置盛沙的蒸发皿。将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝。
的铁圈上,下面放置盛沙的蒸发皿。将适量的炒干的氧化铁粉末和铝粉混合均匀,放在纸漏斗中,上面加少量氯酸钾并在混合物中间插一根镁条,用小木条点燃镁条,引燃氧化铁和铝粉的混合物,反应剧烈进行,发出耀眼的强光,生成铁和氧化铝。
(1)某同学为研究该实验,查阅有关资料得到如下数据:
物质
| Al[]
| Al2O3
| Fe
| Fe2O3
|
熔点/℃
| 660
| 2054
| 1535
| 1462
|
沸点/℃
| 2467
| 2980
| 2750
| -
|
①该同学推测,铝热反应所得到的熔融物是铁铝合金。理由是:该反应放出的热量使铁熔化,而铝的熔点比铁低,此时液态的铁和铝熔合形成铁铝合金。你认为他的解释是否合理??(填“合理”或“不合理”)
②设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用的试剂是?,反应的离子方程式为?。
③实验室溶解该熔融物,下列试剂中最好的是?(填序号)。
A.浓硫酸? B.稀硫酸? C.稀硝酸? D.氢氧化钠溶液
(2)实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价就越低。某同学 取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4摩/升的氢氧化钠溶液,所加氢氧化钠溶液的体积(毫升)与产生的沉淀的物质的量(摩尔)的关系如下图所示。
取一定量上述的熔融物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中,逐滴加入4摩/升的氢氧化钠溶液,所加氢氧化钠溶液的体积(毫升)与产生的沉淀的物质的量(摩尔)的关系如下图所示。
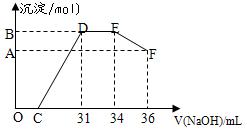
回答下列问题:
①图中OC段没有沉淀生成,此阶段发生反应的离子方程式为
②在DE段,沉淀的物质的量没有变化,则此阶段发生反应的离子方程式为
上 述现象说明溶液中?、
述现象说明溶液中?、 ?、?结合OH-的能力比?强(填离子符号)。
?、?结合OH-的能力比?强(填离子符号)。
③B点与A点的差值为?摩尔。
参考答案:(1)①合理?;②氢氧化钠溶液、2Al+2OH-+2H2O=2AlO2-+3H2 ↑ ;③ B
(2)①OH-+ H+= H2O ②NH4++OH-=NH3·H2O 、H+、Fe3+、Al3+、NH4+③0.008
本题解析:略
本题难度:一般
5、选择题 将等物质的量的Mg和Al混合均匀,分成四等份,分别加到下列四种过量的溶液中,充分反应后,放出H2最多的是:
A.3mol/LHCl溶液
B.4mol/LHNO3溶液
C.8mol/LNaOH溶液
D.18mol/LH2SO4溶液
参考答案:A
本题解析:分析:在镁、铝混合物中加入HNO3和浓H2SO4(两物质均具有强氧化性)都不能产生H2,加入NaOH溶液只有Al与NaOH溶液反应生成H2而与Mg不反应,而加入HCl,Mg和Al都与盐酸反应生成H2,所以H2量最多.
解析:A、盐酸为非氧化性酸,等物质的量的镁和铝都能和盐酸反应生成氢气;
B、硝酸为氧化性酸,与镁、铝反应不会生成氢气;
C、镁不能和氢氧化钠反应,铝和氢氧化钠反应生成氢气;
D、镁与浓硫酸(18mol/LH2SO4)反应生成SO2气体,铝与浓硫酸发生钝化(常温);
有以上分析可知:加入盐酸,等物质的量的镁和铝都与盐酸反应产生氢气,所以氢气量最多.
故选A.
点评:本题考查金属的性质,较易题.主要考查学生运用所学化学知识综合分析和解决实际问题的能力。
本题难度:简单