1、选择题 下列实验操作与预期实验目的或所得实验结论一致的是
[? ]
实验操作
实验目的或结论
A.
将溴乙烷与氢氧化钠溶液共热一段时间,再向冷却后的混合液中滴加硝酸银溶液
检验水解产物中的溴离子
B.
向苯乙烯中加入酸性高锰酸钾,高锰酸钾褪色
说明苯乙烯是苯的同系物
C.
C2H5OH与浓硫酸170℃共热,制得的气体通人酸性KMnO4溶液
检验制得气体是否为乙烯
D.
向苯和酒精的混合液中加入金属钠
确定苯中是否有酒精
参考答案:D
本题解析:
本题难度:一般
2、选择题 某课外实验小组设计的下列实验不合理的是
[? ]
A.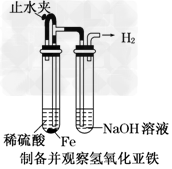
B.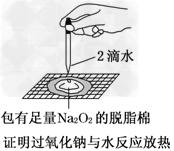
C.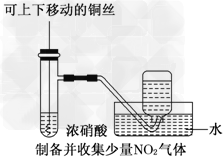
D.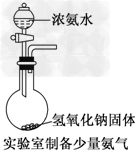
参考答案:C
本题解析:
本题难度:一般
3、选择题 关于下列实验装置的说法中正确的是?
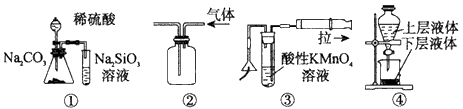
[? ]
A.用图①所示实验可比较硫、碳、硅三种元素的非金属性强弱
B.用图②所示实验装置排空气法收集CO2气体
C.用图③可以检验火柴燃烧生成的SO2气体
D.用图④提取海带中的碘
参考答案:A
本题解析:
本题难度:一般
4、简答题 I、实验室中常以BaSO4重量法测定BaCl2?nH2O中的Ba的含量.主要步骤如下:
①灼烧瓷坩埚至恒重,称得坩埚的质量
②称取BaCl2?nH2O并在烧杯中溶解,加盐酸处理
③将一定浓度的过量硫酸滴入钡盐中得到白色沉淀
④静置,______
⑤将沉淀和滤纸置于瓷坩埚中,经酒精喷灯加热碳化后,继续在800-850℃灼烧至恒重,称重
⑥计算
请回答下列问题:
(1)省略第①步中“灼烧瓷坩埚至恒重”可能导致计算结果______(填“偏高”、“不变”或“偏低”).
(2)第④步静置后的操作是______.
(3)第⑤步灼烧温度不超过900℃,是因为______.
II、某同学用氨水吸收一定量的SO2,吸收后溶液中可能含有OH-、SO32-、SO42-、HSO3-等阴离子中的若干种.
(4)写出氨水吸收过量SO2的反应的离子方程式:______
(5)已知亚硫酸氢盐一般可溶于水.仅限选择的仪器和试剂:烧杯、试管、玻璃棒、胶头滴管;2mol/L盐酸、2mol/L硝酸、1mol/L氯化钡溶液、lmol/L氢氧化钡溶液、品红溶液、蒸馏水.请设计实验探究吸收后溶液中是否存在SO32-、HSO3-,将实验操作、预期的实验现象和结论填在下表中.
| 实验操作 | 预期现象与结论
步骤1:取少量待测液放入试管1中,滴加过量lmol/L氯化钡溶液.
若不出现浑浊,则溶液中不存在SO32-,
若出现浑浊,则溶液中可能含有SO32-.
步骤2:若出现浑浊,静置一段时间后,将上层清液倒入试管2中.往试管1中加入蒸馏水洗涤沉淀,静置后弃去上层清液,再加入______.
______
步骤3:______
红色褪去,则存在HSO3-,红色不褪去,则不存在HSO3-.
或:出现浑浊,则存在HSO3-,不出现浑浊,则不存在HSO3-
|
红色褪去,则存在HSO3-,红色不褪去,则不存在HSO3-.
或:出现浑浊,则存在HSO3-,不出现浑浊,则不存在HSO3-
参考答案:(1)如果省略第①步中“灼烧瓷坩埚至恒重”,瓷坩埚中可能含有部分物质在灼烧时消失,误以为是氯化钡中的结晶水,所以可能导致计算结果偏低,
故答案为:偏低;
(2)第④步静置后的操作中要想得到沉淀,必须进行过滤,沉淀中吸附离子,所以需要洗涤沉淀,
故答案为:过滤、洗涤沉淀;
(3)温度高时,硫酸钡会被碳还原或部分硫酸钡会发生分解
故答案为:硫酸钡会被碳还原(或“部分硫酸钡会发生分解”);
(4)氨水和过量二氧化硫反应生成亚硫酸氢铵,离子方程式为:NH3?H2O+SO2=NH4++HSO3-,
故答案为:NH3?H2O+SO2=NH4++HSO3-;
(5)依据SO32-和HSO3-离子的性质和检验方法设计实验进行检验设计;
结合题干信息和条件,取少量于小烧杯中加入过量氯化钡反应生成沉淀为亚硫酸钡或硫酸钡沉淀;取沉淀加入酸的生成二氧化硫,通过检验二氧化硫的存在方法验证亚硫酸根离子的存在;取滤液依据亚硫酸氢根离子和酸反应可以生成二氧化硫,检验二氧化硫完成实验设计,或通过亚硫酸氢根离子和氢氧化钡反应生成沉淀分析判断;实验设计方法和步骤为:
实验操作预期现象与结论步骤2:2mol/L盐酸.若加盐酸后出现气体,则证明溶液中存在SO32-.
若无气体,则不存在SO32-.步骤3:在试管2中加入过量2mol/L盐酸,再滴入2滴品红.
或:在试管2中加入过量lmol/L氢氧化钡溶液.红色褪去,则存在HSO3-,红色不褪去,则不存在HSO3-.
或:出现浑浊,则存在HSO3-,不出现浑浊,则不存在HSO3-.故答案为:实验操作预期现象与结论步骤2:2mol/L盐酸.若加盐酸后出现气体,则证明溶液中存在SO32-.
若无气体,则不存在SO32-.步骤3:在试管2中加入过量2mol/L盐酸,再滴入2滴品红.
或:在试管2中加入过量lmol/L氢氧化钡溶液.红色褪去,则存在HSO3-,红色不褪去,则不存在HSO3-.
或:出现浑浊,则存在HSO3-,不出现浑浊,则不存在HSO3-.
本题解析:
本题难度:一般
5、选择题 下列实验能达到预期目的的是?
[? ]
A.为检验酸性溶液中的Cl-和SO42- ,先加硝酸银溶液,滤去沉淀后再加硝酸钡溶液
B.向混有碳酸钾的氯化钾溶液中加入适量的盐酸,除去其中的碳酸钾
C.向煮沸的1 mol·L-1 NaOH溶液中滴加FeCl3饱和溶液制备Fe(OH)3胶体
D.用乙醇萃取碘水中的碘
参考答案:B
本题解析:
本题难度:一般