1、简答题 (12分)实验室可用干燥纯净的氨还原氧化铜来制取氮气。根据下列装置图(部分夹持装置略去)回答有关问题:
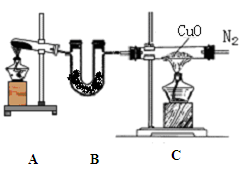
(1)装置B中盛放的药品是?。
(2)写出装置A中反应的化学方程式______?。
(3)写出装置C中反应的化学方程式_________,该反应中的氧化剂是?。
(4)收集到的氮气中除了含有少量水蒸气外,还可能含有另外一种气体,确定是否含有该气体的实验方法是?,实验室收集氮气的方法是?。
参考答案:(1)碱石灰(其它答案合理也可)? (2) Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O
CaCl2+2NH3↑+2H2O
(3) 2NH3+3CuO 3Cu+N2↑+3H2O?CuO
3Cu+N2↑+3H2O?CuO
(4)用湿润的红色石蕊试纸靠近玻璃管口,若试纸变蓝色,证明含有该气体?排水集气法
本题解析: 装置A用于制备氨气,用固体制备,Ca(OH)2+2NH4Cl CaCl2+2NH3↑+2H2O ,B装置干燥氨气,只能选择碱石灰,C装置用于制备氮气,2NH3+3CuO
CaCl2+2NH3↑+2H2O ,B装置干燥氨气,只能选择碱石灰,C装置用于制备氮气,2NH3+3CuO 3Cu+N2↑+3H2O,氧化剂是CuO,收集到的氮气中有杂质氨气和水蒸气,检验氨气用湿润的红色石蕊试纸靠近玻璃管口,若试纸变蓝色,证明含有氨气,收集氮气用排水集气法。
3Cu+N2↑+3H2O,氧化剂是CuO,收集到的氮气中有杂质氨气和水蒸气,检验氨气用湿润的红色石蕊试纸靠近玻璃管口,若试纸变蓝色,证明含有氨气,收集氮气用排水集气法。
本题难度:一般
2、填空题 利用图所示装置收集以下6种气体(图中烧瓶的位置不得变化)。 ①H2②Cl2 ③CH4 ④HCl ⑤NH3⑥SO2 若烧瓶是干燥的,则由A口进气,可收集的气体有(写序号); ____? ;
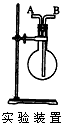
参考答案:①③⑤
本题解析:
本题难度:一般
3、实验题 实验室常用苯甲醛在浓氢氧化钠溶液中制备苯甲醇和苯甲酸,反应式如下:

已知:①苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)
②乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83%~48.0%时易发生爆炸
 ?
?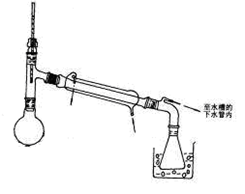
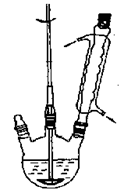
图1?制备苯甲酸和苯甲醇的反应装置图?图2?蒸乙醚的装置图
实验步骤如下:
①向图1所示装置中加入8g氢氧化钠和30mL水,搅拌溶解。稍冷,加入10 mL新蒸过的苯甲醛。开启搅拌器,调整转速,使搅拌平稳进行。加热回流约40 min。
②停止加热,从球形冷凝管上口缓缓加入冷水20mL,摇动均匀,冷却至室温。反应物冷却至室温后,倒入分液漏斗,用乙醚萃取三次,每次10mL。水层保留待用。合并三次萃取液,依次用5 mL饱和亚硫酸氢钠溶液洗涤,10mL 10%碳酸钠溶液洗涤,10 mL水洗涤。
③分出醚层,倒入干燥的锥形瓶,加无水硫酸镁,注意锥形瓶上要加塞。将锥形瓶中溶液转入图2所示蒸馏装置,缓缓加热。升高温度蒸馏,当温度升到140℃时改用空气冷凝管,收集198℃~204℃的馏分得产品A。将萃取后的水溶液慢慢地加入到盛有30 mL浓盐酸和30 mL水的混合物中,同时用玻璃棒搅拌,析出白色固体。冷却,抽滤,得到粗产品,然后提纯得产品B。
根据以上步骤回答下列问题:
(1)步骤①中所加的苯甲醛为什么要是新蒸的?________________________________。
(2)步骤②萃取时用到的玻璃仪器除了除烧杯、玻璃棒外,还需______________________,饱和亚硫酸氢钠溶液洗涤是为了除去__________________,而碳酸钠溶液洗涤是为了除去醚层中极少量的苯甲酸。
(3)步骤③中无水硫酸镁的作用是_________________,将锥形瓶中溶液转入图2所示蒸馏装置时涉及的实验操作为__________________。
(4)产品A为____________,蒸馏除乙醚的过程中采用的加热方式为_______________,提纯产品B所用到的实验操作为________________。
参考答案:1)保存时间较长的苯甲醛已部分氧化成苯甲酸会使苯甲醇的产量相对减少。
(2)分液漏斗,未反应完的苯甲醛。
(3)干燥剂,过滤。?(4)苯甲醇,水浴加热,重结晶。
本题解析:(1)步骤①中所加的苯甲醛要是新蒸的,因为保存时间较长的苯甲醛已部分氧化成苯甲酸会使苯甲醇的产量相对减少;(2)步骤②萃取时用到的玻璃仪器除了除烧杯、玻璃棒外,还需分液漏斗,亚硫酸氢钠能够与苯甲醛反应,所以饱和亚硫酸氢钠溶液洗涤是为了除去反应完的苯甲醛,(因为乙醚为有机溶剂,所以萃取后溶质为苯甲酸、苯甲醛、苯甲醇,根据后一个空可以推断该空应该填苯甲醛);③分出醚层,倒入干燥的锥形瓶,加无水硫酸镁,注意锥形瓶上要加塞,由此可以推断出无水硫酸镁的作用是作为干燥剂,除去水分,将锥形瓶中溶液转入图2所示蒸馏装置过程中,需要将硫酸镁过滤掉;(4)产品A为苯甲醇,蒸馏除乙醚的过程中采用的加热方式为水浴加热,因为乙醚沸点34.6℃,密度0.7138,易燃烧,当空气中含量为1.83%~48.0%时易发生爆炸,所以不能用明火加入,必须采用水浴加热;B为苯甲酸,由题干中苯甲酸在水中的溶解度为:0.18g(4℃)、0.34g(25℃)、0.95g(60℃)、6.8g(95℃)可以知道,苯甲酸的溶解度受温度的影响很大,所以采用重结晶的方法可以提纯B。
点评:本题考查了有机合成,该考点是高考考查的重点和难点,本题有一定的综合性,该题要合理利用题干的信息,本题有一定的难度。
本题难度:简单
4、选择题 用0.20mol/L的NaOH溶液滴定100.0mL0.20mol/LHCl溶液时,滴定误差在±0.1%以内,反应完毕后溶液的pH变化范围是
A.5~9
B.4.0~10.0
C.4.3~9.7
D.以上都不正确
参考答案:B
本题解析:(1)计量点前计量点前误差为+0.1%时,即滴入NaOH的体积为99.9mL,NaOH不足。
此时锥形瓶溶液中是中和生成的NaCl和剩余的HCl。所以只要计算该溶液的PH值即可。
剩余的n(HCl)=n(HCl总)-n(NaOH)=0.2*(100.00-99.9)*10^-3=2*10^-6(mol)
则PH(前)=lg[c(HCl)]=4。
(2)计量点后半滴,即加入NaOH的体积为100.1mL,NaOH过量,此时为NaCl和NaOH的混合溶液,所以计算时只需考虑NaOH即可。
n(NaOH过量)=n(NaOH总)-n(NaOH反应)=0.2*(100.1-100)*10^-3)=2*10^-5(mol)
此时溶液体积v=100.00+100.1=200.1mL=200.1*10^-3(L),
所以[OH-]=n(NaOH过量)/v="2*10^-5/(200.1*10^-3)=1/100.05" *10^-2(mol/L)
[H+]=10^-14/[OH-]? PH(后)=-lg[H+]=10所以突跃范围为4~10。故选B。
点评:酸碱中和滴定突跃范围的计算实际上也是强酸、强碱互相混合的计算,其规律是
(3)酸I+碱II
完全中和:[H+] =" [OH-]" = 1 mol/L
mol/L
酸过量:? [H+]= 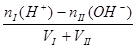
碱过量:[OH-] = 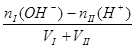
滴定突跃范围指计量点前半滴和后半滴滴定剂所引起的锥形瓶中溶液PH值的变化范围。要控制误差为+/-0.1%时。由于计量点时酸碱恰好完全反应,也就是滴入NaOH的体积为100.00mL时达计量点,所以计量点前误差为+0.1%时,是指加入NaOH的体积为99.9mL,而计量点后误差为-0.1%时指加入NaOH的体积为100.1mL。因此计算滴定突跃范围,只要计算出计量点前、后半滴时锥形瓶中溶液的PH(前)和PH(后)即可。
本题难度:简单
5、选择题 实验室制取下列气体时,不能用排水法收集,而只能用排气法收集的是:
A.NH3
B.O2
C.H2
D.NO
参考答案:A
本题解析:略
本题难度:简单