1、填空题 (10分)关注饮用水,保证人民的生活质量。回答下列两个问题:
(1)饮用水中的NO3— 对人类健康会产生危害,为了降低饮用水中NO3—的浓度,可以在碱性条件下用铝粉将NO3-还原为N2,其化学方程式为:
10Al + 6NaNO3 + 4NaOH = 10NaAlO2 + 3N2↑+ 2H2O。请回答下列问题:
①上述反应中,?元素的化合价升高,则该元素的原子?(填“得到”或“失去”)电子。
②用“单线桥法”表示反应中电子转移的方向和数目:
10 Al+ 6 NaNO3 + 4 NaOH =" 10" NaAlO2 + 3 N2↑+ 2 H2O
(2)洪灾过后,饮用水的消毒杀菌成为抑制大规模传染性疾病爆发的有效方法之一。漂白粉是常用的消毒剂。
①工业上将氯气通入石灰乳[Ca(OH)2]制取漂白粉,化学方程式为
?。
②漂白粉的有效成分是(填化学式)?。
③漂白粉溶于水后,受空气中的CO2作用,即产生有漂白、杀菌作用的次氯酸,离子方程式为?。
参考答案:(10分)(1)①⑴? Al (1分),失去。(1分)
② (2分)
(2分)
(2)①? 2Ca(OH)2+2Cl2=CaCl2+Ca(ClO)2+2H2O(2分)②? Ca(ClO)2(2分)
③ Ca2++2ClO-+CO2+H2O=CaCO3↓+2HClO(2分)
本题解析:略
本题难度:简单
2、填空题 氯气是工业生产中的重要原料,含氯消毒剂在生活中有着广泛的用途。
(1)工业生产通过电解饱和食盐水获取大量氯气,化学方程式为?。
(2)氯气可用于制取84消毒液(有效成分为NaClO),离子方程式为?。
(3)下列措施能增强84消毒液杀菌能力的是?。
A.加入适量醋酸? B.加入适量亚硫酸? C.加入少量NaOH粉末
(4)氯气与氢氧化钠溶液反应,若所得溶液恰好为中性,则溶液中离子浓度关系正确的是?。
A.c(Na+) + c(H+) = c(OH-) + c(Cl-)
B.c(Na+) = c(ClO-) + c(Cl-)
C.c(Na+) = 2c(ClO-) + c(HClO)
(5)84消毒液不能用于消毒钢铁(含Fe、C)制品,易发生电化学腐蚀,钢铁制品表面生成红褐色沉淀。正极反应为?。
参考答案:(7分)
(1)2NaCl + 2H2O  2NaOH + H2↑+ Cl2↑ (1分)
2NaOH + H2↑+ Cl2↑ (1分)
(2)Cl2 + 2OH-= Cl-+ ClO-+ H2O?(1分)
(3)A?(1分)
(4)B C(2分,少选得1分,多选、错选不得分)
(5)ClO-+2e-+ H2O→Cl-+2OH-(2分)
本题解析:
(1)工业生产通过电解饱和食盐水化学方程式为:2NaCl + 2H2O  2NaOH + H2↑+ Cl2↑
2NaOH + H2↑+ Cl2↑
(2)氯气与氢氧化钠溶液反应离子方程式:Cl2 + 2OH-= Cl-+ ClO-+ H2O?
(3)存在ClO-+ H2O HClO+OH-水解平衡,A ,加入醋酸可以消耗OH-,是平衡正移,增大HClO,正确;B、亚硫酸会与HClO发生氧化还原反应,错误;C、NaOH会增大溶液中OH-的浓度,使平衡逆移,会减小HClO浓度,错误。
HClO+OH-水解平衡,A ,加入醋酸可以消耗OH-,是平衡正移,增大HClO,正确;B、亚硫酸会与HClO发生氧化还原反应,错误;C、NaOH会增大溶液中OH-的浓度,使平衡逆移,会减小HClO浓度,错误。
(4)A、溶液存在电荷守恒:c(Na+) + c(H+) = c(OH-) + c(Cl-)+ c(ClO-),错误;B、由电荷守恒,和溶液呈中性:c(H+) = c(OH-),知c(Na+) = c(ClO-) + c(Cl-),正确;C、根据氯发生歧化反应物料守恒知:c(ClO-) + c(HClO) =c(Cl-),结合c(Na+) = c(ClO-) + c(Cl-),得c(Na+) = 2c(ClO-) + c(HClO),正确。
(5)ClO-的强氧化性会氧化铁,所以正极反应为:ClO-+2e-+ H2O→Cl-+2OH-。
本题难度:一般
3、填空题 盐酸、硫酸和硝酸都是重要的化工原料,也是化学实验室里必备的重要试剂。请回答下列问题:
(1) 常温下,可用铁、铝制的容器盛放浓硫酸,说明浓硫酸具有?性,用玻璃棒蘸取浓硫酸滴在纸上,纸逐渐变黑,说明浓硫酸具有?性,实验室不能用浓硫酸干燥氨气,说明硫酸具有?性。
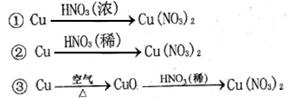
(2) 硝酸铜是制备Cu-Zn-Al系催化剂的重要原料,工业上用洗净的废铜屑作原料来制备硝酸铜。右图所示制备方法符合“绿色化学”思想的
是?(填序号)。
(3) ①在100ml 18 mol/L浓硫酸中加入过量铜片,加热使之充分反应,产生的气体在标准状况下的体积可能是?。
A.40.32 L
B.30.24 L
C.20.16 L
D.13.44 L