1、选择题 氢氰酸(HCN)的下列性质中,可以证明它是弱电解质的是
A.HCN易溶于水
B.1mol/L氢氰酸溶液的pH约为3
C.10 mL1mol/LHCN恰好与10 mL 1mol/L NaOH溶液完全反应
D.HCN溶液的导电性比盐酸溶液的弱
2、选择题 下列说法中正确的是( )
A.将纯水加热至较高温度,Kw变大、pH变小、呈酸性
B.保存FeSO4溶液时,应在其中加入稀HNO3以抑制Fe2+水解
C.AlCl3溶液蒸干、灼烧至恒重,最终剩余固体是AlCl3
D.向0.1?mol?L-1?氨水中加入少量水,pH减小,
增大
3、选择题 体积相同,浓度均为0.1 mol/L的NaOH溶液、氨水,分别加水稀释m倍、n倍,溶液的pH都变成9,则m与n?的关系为
A.4m=n
B.m=n
C.m<n
D.m>n
4、选择题 化合物HIn在水溶液中因存在以下电离平衡,故可用作酸碱指示剂
HIn(红色溶液) 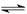 H+(溶液)+ In-(黄色溶液)
H+(溶液)+ In-(黄色溶液)
浓度为0.02 mol·L-1的下列各溶液: ①盐酸②石灰水③NaCl溶液 ④NaHSO4溶液 ⑤NaHCO3溶液 ⑥氨水,⑦AlCl3溶液其中能使指示剂显红色的是
5、填空题 运用化学反应原理研究氮、氧等单质及其化合物的反应有重要意义。

若在恒温、恒压条件下向平衡体系中通入氯气,平衡_________移动(填“向左”“向右”或“不”);使用催化剂_________反应的△H(填“增大”“减小”或“不改变”)。
(2)已知:
O2(g)=O2+(g)+e- △H1=1175. 7 kJ/mol
PtF6(g)+e-=PtF6-(g) △H2=-771. l kJ/mol
O2+PtF6-(s)=O2+(g)+PtF6-(g) △H3=482. 2 kJ/mol
则反应O2(g) +PtF6(g)=O2+PtF6-(s)的△H=___________kJ/mol
(3)在25℃下,向浓度均为0.1 mol/L的MgCl2和CuC12混合溶液中逐滴加入氨水,先生成__________沉淀(填化学式),生成该沉淀的离子方程式为__________________。已知25℃时,Ksp[Mg(OH)2] =1.8×
10-11 ksp[Cu(OH)2] =2.2×l0-20
(4)在25℃下,将amol/L的氨水与0.01mol/L的盐酸等体积混合,反应平衡时溶液中c(NH4+)=c(Cl-),则溶液显_________性(填“酸”“碱”或“中”);用含a的代数式表示NH3·H2O的电离常数Kb=
____________。