1、选择题 盐酸、醋酸、碳酸钠和碳酸氢钠是生活中常见的物质,下列表述正确的是
[? ]
A.在Na2CO3溶液中加入与其溶质等物质的量的冰醋酸,溶液中存在:
c(Na+) =c(CH3COOH) +c(CH3COO-)+ c(CO32-) +c(HCO3-) +c(H2CO3)
B.NaHCO3溶液中存在:c(H+)+c(H2CO3)=c(OH-)
C.10 mL1.0mol/L CH3COOH溶液中加入0.01 mol的NaOH后,溶液中离子浓度的大小关系为:
c(Na+)= c(CH3COO-)>c(OH-)=c(H+)
D.相同条件下,中和体积与pH都相同的HCl溶液和CH3COOH溶液所消耗的NaOH物质的量前者大
2、选择题 已知在含氧酸中只有H原子与O原子相连时,才能在水溶液中电离出H+。次磷酸与足量的氢氧化钠溶液 反应的产物为NaH2PO2,又知浓度均为0.1mol/L的次磷酸(H3PO2)与盐酸相比前者导电能力弱。据此判断下列说法中正确的是
[? ]
A.次磷酸是二元弱酸,在水中的电离方程式为H3PO2 H++H2PO2-
H++H2PO2-
B.次磷酸的结构中,只有一个H原子与O原子直接相连
C.次磷酸是一元弱酸,在水中的电离方程式为H3PO2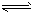 H++H2PO2-
H++H2PO2-
D.0. 1mol/L次磷酸可与等体积的0.2mol/L氢氧化钠溶液完全中和
3、选择题 中和相同体积、相同pH的硫酸、盐酸和醋酸三种稀溶液,所用相同浓度的NaOH溶液的体积分别为V1、V2、V3,则三者的大小关系为(? )?
A.V3>V2>V1
B.V3=V2>V1?
C.V3>V2=V1
D.V1=V2>V3
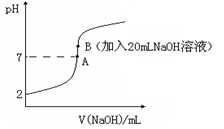
4、填空题 (14分)氢氟酸(HF)是一元弱酸,在水溶液中的电离方程式为:HF H++F-。25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示。
H++F-。25℃下,向20mL0.2mol?L-1的氢氟酸中滴加0.2mol?L-1的NaOH溶液时,溶液的pH变化如图所示。
已知:电离度(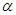 )和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力,
)和电离平衡常数(K)一样,可以用来衡量弱电解质在稀溶液中的电离能力, 。
。
请回答下列问题:
(1)在氢氟酸的稀溶液中,通过改变以下条件能使氢氟酸的电离度[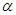 (HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_______。
(HF)]增大的是_______,可使氢氟酸的电离平衡常数[Ka(HF)] 增大的是_______。
a.升高温度? b.向溶液中滴入2滴浓盐酸? c.加入少量NaF固体? d.加水稀释
(2)在此温度下,氢氟酸的电离平衡常数Ka(HF)为:__??(保留两位有效数字),电离度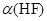 约为___?_%。
约为___?_%。
(3)已知在此温度下:
H+(aq)+OH-(aq)=H2O(1)? △H=-a kJ?mol -1;
?HF(aq)  ?H+(aq)+F-(aq)? △H=+b kJ?mol -1
?H+(aq)+F-(aq)? △H=+b kJ?mol -1
则该过程中和反应的热化学方程式为:________________________________??;在忽略F-水解的情况下,反应达到B点时,滴加过程中所释放的热量为________kJ(用只含a、b的式子表示)。
(4)下列有关图中各点微粒浓度关系正确的是_______________。
a.在A处溶液中:c(F—)+c(HF)="0.2" mol?L-1?
b.在B处溶液中:c(H+)+c(HF)= c(OH—)
c.在B处溶液中:c(Na+)>c(F—)>c(H+)>c(OH—)?
d.在A和B处溶液中都符合: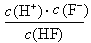 = Ka(HF)
= Ka(HF)
5、选择题
A.溶液的pH增加
B.CH3COOH电离度变大
C.溶液的导电能力减弱
D.溶液中[OH-]减小