1、选择题 向两份0.1mol/L?CH3COONa溶液中分别加入少量NH4NO3、Na2CO3固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为( )
A.减小、减小
B.增大、增大
C.减小、增大
D.增大、减小
参考答案:CH3COONa是强碱弱酸盐,它的水解方程式为 CH3COO-+H2O=CH3COOH+OH-,向醋酸钠溶液中加入硝酸铵,硝酸铵是强酸弱碱盐能水解,硝酸铵的水解方程式为NH4++H2O=NH3.H2O+H+,硝酸铵水解后生成的氢离子和醋酸根离子水解生成的氢氧根离子反应生成弱电解质水,所以硝酸铵能促进醋酸钠水解,导致醋酸根离子的浓度减小;
向醋酸钠溶液中加入碳酸钠,碳酸钠是强碱弱酸盐能水解,碳酸钠的水解方程式为CO32-+H2O=HCO3-+OH-,碳酸根离子水解也生成氢氧根离子,所以能抑制醋酸根离子的水解,导致醋酸根离子浓度增大,故选C.
本题解析:
本题难度:简单
2、选择题 Mg(OH)2在水中达到溶解平衡:Mg(OH)2(s) Mg2++2OH-,下列哪种情况可使Mg(OH)2(s)的量减少( )
Mg2++2OH-,下列哪种情况可使Mg(OH)2(s)的量减少( )
A.加入MgCl2溶液
B.加入少量NaOH
C.加入NH4NO3溶液
D.加入K2S溶液
参考答案:C
本题解析:A使[Mg2+]增大,B使[OH-]增大,均使平衡逆向移动,Mg(OH)2(s)的量增加,加入K2S溶液,S2-水解呈碱性,抑制Mg(OH)2固体溶解;加入NH4NO3,NH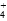 与OH-结合生成NH3·H2O,使[OH-]减小,平衡向右移动,促进Mg(OH)2(s)溶解。
与OH-结合生成NH3·H2O,使[OH-]减小,平衡向右移动,促进Mg(OH)2(s)溶解。
本题难度:一般
3、选择题 将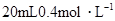 硝酸铵溶液跟
硝酸铵溶液跟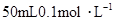 氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是( )
氢氧化钡溶液混合,则混合溶液中各离子浓度的大小顺序是( )
A.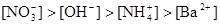
B.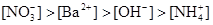
C.
D.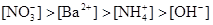
参考答案:B
本题解析:NH4NO3的物质的量为:0.02×0.4=0.008mol,Ba(OH)2的物质的量为:0.05×0.1=0.005mol,OH-为0.01mol。首先两溶液混合要考虑下列反应:NH4++OH-=NH3·H2O,OH-剩余0.002mol。由上述分析可得: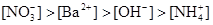 ,答案选B。
,答案选B。
本题难度:一般
4、选择题 对于0.1mol?L-1?NH4Cl溶液,正确的是( )
A.升高温度,溶液pH升高
B.通入少量HCl,c(NH4+)和c(Cl-)均增大
C.c(NH4+)+c(OH-)=c(Cl-)+c(H+)
D.c(Cl-)>c(H+)>c(NH4+)>c(OH-)
参考答案:A.升高温度促进水解,NH4Cl水解,氢离子浓度增大,溶液pH降低,故A错误;
B.氢离子抑制氯化铵的水解,铵根浓度增大,加入了氯化氢,氯离子浓度增大,故B正确;
C.氯化铵不水解,铵根浓度与氢氧根相等,铵根水解,铵根浓度减少,氢离子浓度增大,故C错误;
D.水解程度很微弱,氢离子浓度小于铵根浓度,故D错误.
故选B.
本题解析:
本题难度:简单
5、选择题 四种盐都是一元酸和一元碱反应生成的,实验测得盐AX和BY的水溶液pH都等于7,AY的水溶液pH>7,BX水溶液pH<7,下列结论正确的是()
A.盐AX和BY没有发生水解,盐AY和BX发生了水解
B.酸性HX>HY,碱性AOH>BOH
C.等物质的量的AY和BX的混合物溶于水,溶液呈中性
D.等物质的量浓度的HX溶液和HY溶液的pH前者大于后者
参考答案:BC
本题解析:实验测得盐AX和BY的水溶液pH都等于7,说明A+和X-、B+和Y-的水解程度相近或不水解,AX和BY可能是强酸强碱盐,也可能是弱酸弱碱盐。AY的水溶液pH>7,A+的水解程度小于Y-(或不水解),BX水溶液pH<7,X-的水解程度小于B+(或不水解),综合分析,A+的水解程度小于B+,X-的水解程度小于Y-,“越弱越水解”,所以,酸性HX>HY,碱性AOH>BOH。
本题难度:简单