1、选择题 下列物质中属于纯净物的是
A.铝热剂
B.铝土矿
C.明矾
D.含镁60%的MgO
参考答案:C
本题解析:明矾是十二水硫酸铝钾,属于纯净物.
本题难度:简单
2、选择题 下列叙述正确的是(?)
A.除零族元素外,短周期元素的最高化合价在数值上都等于该元素所属的族序数
B.X、Y均为短周期元素,其简单离子mXa+与nYb-的电子层结构相同,则m+a=n-b。
C.结合质子(H+)能力:OH->CH3COO->Cl-
D.F、Cl、Br的最外层电子数都是7,次外层电子数都是8
参考答案:C
本题解析:略
本题难度:一般
3、选择题 下列物质互为同分异构体的一组是( )?
A.35 Cl和37 Cl
B.正丁烷和异丁烷
C.O2 和 O3
D.H2O 和 H2O2
参考答案:B
本题解析:A、35 Cl和 37 Cl互为同位素,错误;B、正丁烷和异丁烷互为同分异构体,正确;C、O2 和 O3互为同素异形体,错误;D、H2O 和 H2O2分子式不同,不是同分异构体,错误。
本题难度:一般
4、填空题
已知A、B、C、D和E 5种分子所含原子数目依次为1、2、3、4和6,且都含有18个电子。又知B、C和D是由两种元素的原子组成。请回答:
(1)组成A分子的原子的核外电子排布式是?;
(2)B和C的分子式分别是?和?;C分子的立体结构呈?型,该分子属于?分子(填“极性”或“非极性”);
(3)若向D的稀溶液中加入少量二氧化锰,有无色气体生成。则D的分子式是?,该反应的化学方程式为?;
(4)若将1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,则E的分子式是?。
参考答案:答案:(1)1s22s22p63s23p6?(2)HCl? H2S? V?极性?(3)H2O2? 2H2O2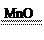 2H2O+O2↑(4)CH4O
2H2O+O2↑(4)CH4O
本题解析:
(1)因A有18个电子且只有1个原子,所以A为18号元素Ar,按照核外电子排布规律可以写出其电子排布式为1s22s22p63s23p6 。
(2)B、C两分子均有2种元素组成的,是分别含有2和3个原子的18电子的分子,所以B为HCl,C为H2S,H2S的结构与水分子的结构相似均为“V”型的极性分子。
(3)因为D分子中含有4个原子、2种元素、18个电子,且在溶液中加入MnO2后生成无色气体,所以D为H2O2 。反应的化学方程式为2H2O2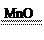 2H2O+O2↑。
2H2O+O2↑。
(4)因为1mol E在氧气中完全燃烧,只生成1mol CO2和2molH2O,所以1个E分子中含有1个C原子和4个H原子。又因为E分子中含有6个原子且为18电子分子,因此E中含有的另一个原子为O原子。因此E的化学式为CH4O。
本题难度:一般
5、选择题 现有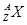 和
和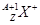 两种粒子,下列叙述正确的是?
两种粒子,下列叙述正确的是?
A.质子数相等
B.X元素的质量数为A
C.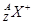 一定具有稀有气体元素原子的核外电子排布
一定具有稀有气体元素原子的核外电子排布
D.它们的化学性质几乎完全相同
参考答案:A
本题解析: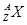 表示质子数为Z,质量数为A的X原子,故A对B错;C、如H1+最外层不是稀有气体的稳定结构;D、化学性质不同。
表示质子数为Z,质量数为A的X原子,故A对B错;C、如H1+最外层不是稀有气体的稳定结构;D、化学性质不同。
本题难度:一般