1、选择题 只用一种试剂可区别Na2SO4、MgCl2、FeCl2、Al2(SO4)3、FeCl3和CuSO4六种溶液,,这种试剂是
A.Ba(OH)2
B.H2SO4
C.NaOH
D.AgNO3
参考答案:C
本题解析:试题分析:六种盐溶液的阳离子各不相同,可从阳离子鉴别的角度分析,鉴别阳离子,可加入碱,结合沉淀的颜色、氢氧化铝的两性等角度判断。加入Ba(OH)2,以上六种物质都反应,且沉淀的颜色有的是相同的,不能鉴别,故A错误;加入硫酸,以上六种物质都不反应,不能鉴别,故B错误;加入NaOH,Na2SO4无现象。氯化镁生成白色沉淀。FeCl2生成白色沉淀,迅速变成灰绿色,最后总变成红褐色。Al2(SO4)3生成白色沉淀,NaOH过量时,沉淀逐渐溶解。氯化铁生成红褐色沉淀;CuSO4生成蓝色沉淀,现象各不相同,可鉴别,故C正确,加入AgNO3,以上物质都生成白色沉淀,不能鉴别,故D错误;答案选C。
考点:考查物质的检验和鉴别的基本方法
点评:该题是高考中的常见题型,属于中等难度的试题,试题综合性强,侧重对学生能力的培养。本题注意把握四种物质的组成上的异同,从反应具有不同现象的角度考虑。该类试题需要明确的是在进行物质的检验时,要依据物质的特殊性质和特征反应,选择适当的试剂和方法,准确观察反应中的明显现象,如颜色的变化、沉淀的生成和溶解、气体的产生和气味、火焰的颜色等,进行判断、推理、验证即可。
本题难度:简单
2、填空题 ①②③④⑤五种元素,在元素周期表中的位置如图所示。回答下列问题:?
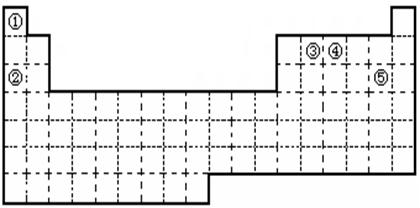
(1)①②③④⑤五种元素中,金属性最强的元素是?(写元素名称), 该元素的单质在空气中燃烧的化学方程式为? ?。
(2)元素②的最高价氧化物对应的水化物属于?化合物,(填“共价”或“离子” ),其电子式为 ?, 试比较②和③原子半径的大小
②?③(填“﹥” 或“﹤” )
(3)画出元素④的原子结构示意图?,该元素的最高价氧化物的
水化物能与Cu发生反应,反应中作氧化剂的是(写化学式)?。
(4)写出元素⑤在周期表中的位置?,以海水中含量最大的物质为原料可以生产⑤的单质,同时还可以得到另外两种重要的工业原料,该反应的化学方程式为? ?。
(5)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,乙元素原子核外L层电子数是M层电子数的4倍。
①甲、乙元素分别为??、 ?(写元素名称)
②写出②的最高价氧化物对应的水化物与甲的最高价氧化物反应的离子方程式??
参考答案:(1) 钠 (1分)?2Na + O2  ?Na2O2(2分)
?Na2O2(2分)
(2) 离子?电子式略?﹥?(各1分)?
电解
?(3)?略,? HNO3(各1分)?(4) 第三周期ⅦA 族 (1分)2NaCl +2H2O =Cl2↑+H2↑+2NaOH(2分)
(5)①铝、镁(各1分)?
②2NaOH+Al2O3=2Na AlO2+H2O(2分)
本题解析:根据元素所在周期表中的位置可知:①为H元素,②为Na元素,③为C元素,④为N元素,⑤为Cl元素。
(1)同周期中元素的金属性从左到右逐渐减弱,同主族元素的金属性从上到下逐渐增强,则金属性最强为Na,在氧气中燃烧的化学方程式为2Na + O2  ?Na2O2。
?Na2O2。
(2)元素②的最高价氧化物对应的水化物为NaOH,为离子化合物,电子式为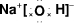 ,钠的原子核外有3个电子层,C的原子核外有2个电子层,核外电子层数越多,半径越大,故②>③;
,钠的原子核外有3个电子层,C的原子核外有2个电子层,核外电子层数越多,半径越大,故②>③;
(3)④为N元素,原子核外有2个电子层,最外层电子数为5,原子结构示意图为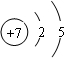 ,其对应的最高价氧化物的水化物为HNO3,具有强氧化性,与铜反应时做氧化剂。
,其对应的最高价氧化物的水化物为HNO3,具有强氧化性,与铜反应时做氧化剂。
电解
?(4)⑤为Cl元素,原子核外有3个电子层,最外层电子数为7,所以在第三周期ⅦA族,电解饱和食盐水的产物为氢氧化钠、氢气和氯气,反应的方程式为2NaCl+2H2O=Cl2↑+H2↑+2NaOH。(5)①甲元素单质在冷的浓硫酸或空气中,表面都生成致密的氧化膜,发生钝化反应,应为铝单质,乙元素原子核外L层电子数是M层电子数的4倍,应为镁元素,故答案为:铝;镁;②的最高价氧化物对应的水化物与甲的最高价氧化物的反应为氢氧化钠和氧化铝的反应,氧化铝为两性氧化物,与氢氧化钠反应生成偏铝酸钠和水,反应的化学方程式为
2NaOH+Al2O3=2NaAlO2+H2O。
点评:本题考查较为综合,涉及元素的推断、元素周期律、氧化还原反应、电解以及化学反应与能量等问题,题目难度中等,注意正确把握元素周期律的递变规律以及相关基础之知识的积累.
本题难度:一般
3、选择题 一定量某物质的溶液,其质量分数为0.2A,当加入等体积的水稀释后,其质量分数小于0.1A,则该溶液的密度
A.大于水的密度
B.小于水的密度
C.等于水的密度
D.无法确定
参考答案:B
本题解析:
本题难度:困难
4、选择题 甲、乙为短周期元素的单质,丙、丁为氧化物,它们存在如下转化关系:
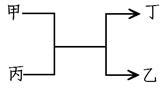
则甲和乙可以是
A.钠和氢气
B.镁和碳
C.氧气和硫
D.铝和铁
参考答案:B
本题解析:选项A,若甲为Na,乙为H2,则丙为H2O,丁为NaOH,NaOH不是氧化物,符合题意。选项B,若甲为Mg,乙为C,则丙为CO2,丁为MgO,符合题意。选项C,若甲为O2,乙为S,则丙为H2S,丁为H2O,H2S不是氧化物,不符合题意。选项D,铁不是短周期元素,不符合题意。
本题难度:一般
5、选择题 X、Y、Z、W均为短周期元素,它们在周期表中的位置如下图所示。若X原子的最外层电子数比其次外层电子数多3个,下列说法错误的是(? )
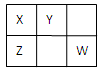
A.原子半径:Z>X>Y
B.最高价氧化物对应水化物的酸性:Z>W
C.四种元素的氢化物中,Y的氢化物沸点最高
D.阴离子的还原性:Z<W
参考答案:BD
本题解析:根据元素在周期表中的位置可判断,X是第二周期。X原子的最外层电子数比其次外层电子数多3个,所以X是氮元素。则Y是氧元素,Z是磷元素,W是氯元素。同主族自上而下原子半径逐渐增大,金属性逐渐增强,非金属性逐渐减弱,最高价氧化物的水化物的酸性逐渐减弱。同周期自左向右,原子半径逐渐减小,金属性逐渐减弱,非金属性逐渐增强。所以A正确,B不正确,最高价氧化物对应水化物的酸性应该是W>Z。水中含有氢键,所以沸点最高,C正确。非金属性越强,相应阴离子的还原性就越弱,所以D不正确,阴离子的还原性是Z>W。答案选BD。
本题难度:一般