1、填空题 将盛有NO2N2O4混合气体的平衡球一端放入热水中,另一端放入冷水中,则放入热水的一端颜色______另一端颜色______.
参考答案:平衡2NO2(g)?N2O4(g)△H<0,升高温度向吸热方向移动,即逆反应方向移动,NO2浓度增大,颜色加深,所以放入热水的一端颜色变深,另一端颜色变浅;
故答案为:变深;变浅.
本题解析:
本题难度:一般
2、选择题 A、B的混合气体在密闭容器中发生如下反应:xA(g)+yB(g) zC(g) ΔH<0。达到化学平衡后测得A的浓度为0.20 mol·L-1;保持温度不变,将密闭容器的容积缩小至原来的一半,再次达到平衡时,测得A的浓度为0.35 mol·L-1。则下列有关判断正确的是
zC(g) ΔH<0。达到化学平衡后测得A的浓度为0.20 mol·L-1;保持温度不变,将密闭容器的容积缩小至原来的一半,再次达到平衡时,测得A的浓度为0.35 mol·L-1。则下列有关判断正确的是
A.平衡向逆反应方向移动了 B. x+y>z
C.B的转化率下降 D.C的体积分数减小
参考答案:B
本题解析:达到化学平衡后测得A的浓度为0.20 mol·L-1;保持温度不变,将密闭容器的容积缩小至原来的一半,若平衡不发生移动,则压缩后A的浓度为0.40mol/L而实质上再次达到平衡时,测得A的浓度为0.35 mol·L-1,说明增大压强,平衡向正反应方向移动。根据平衡移动原理:增大压强,化学平衡向气体体积减小的反应移动,所以x+y>z。故选项B正确,选项A错误;平衡正向移动,反应物B的转化率增大,选项C错误;平衡正向移动,则生成物C的含量增大,即C的体积分数增大,选项D错误。
考点:考查压强对化学平衡、物质的转化率及平衡含量的影响的知识。
本题难度:一般
3、填空题 I、如下图所示,在容器A中装有20℃的水50 mL,容器B中装有1 mol/L的盐
酸50 mL,试管C、D相连通,且其中装有红棕色NO2和无色N2O4的混合气体,并处于下列平
衡:2NO2
参考答案:
本题解析:
本题难度:一般
4、计算题 把2.5 mol A和2.5 molB两种气体混合放入容积为2L的密闭容器里发生反应3A(g)+B(g) XC(g)+2D(g),经5S后反应达到平衡,在此5S内C的平均反应速率为0.2mol/(L· s),同时生成1 mol D,试求:
XC(g)+2D(g),经5S后反应达到平衡,在此5S内C的平均反应速率为0.2mol/(L· s),同时生成1 mol D,试求:
⑴在此5S内D的平均反应速率。
⑵计算X的值
参考答案:5S内C的平均反应速率为0.2mol/(L· s)
所以生成C的物质的量是0.2mol/(L· s)×2L×5s=2.0mol
因为物质的变化量之比是相应的化学计量数之比
所以X=4
又因为速率之比是相应的化学计量数之比
所以5S内D的平均反应速率0.2mol/(L· s)÷2=0.1mol/(L· s)
本题解析:考查可逆反应的有关计算。
本题难度:一般
5、选择题 用于净化汽车尾气的反应:2NO(g)+2CO(g)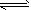 2CO2(g)+N2(g),已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是
2CO2(g)+N2(g),已知该反应速率极慢,570 K时平衡常数为1×1059。下列说法正确的是
[? ]
A.装有尾气净化装置的汽车排出的气体中不再含有NO或CO
B.提高尾气净化效率的常用方法是升高温度
C.提高尾气净化效率的最佳途径是研制高效催化剂
D.570 K时该反应正向进行的程度很大,故使用催化剂并无实际意义
参考答案:C
本题解析:
本题难度:一般