1、选择题 一定温度下,在恒容密闭容器中发生如下反应:2A(g) + B(g)  3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数仍为a%的是( )
3C(g),若反应开始时充入2molA和2molB,达平衡后A的体积分数为a%。其它条件不变时,若按下列四种配比作为起始物质,平衡后A的体积分数仍为a%的是( )
A.2mol C B.2molA、1molB和1molHe(不参加反应)
C.1molB和1molC D.2molA、3molB和3molC
参考答案:D
本题解析:若平衡后A的体积分数仍为a%,要求与开始时充入2molA和2molB达到的平衡态为等效平衡,反应为前后气体分子数目不变的反应,只要将生成物完全极限转化成为反应物后,与原初始态加入的A、B物质的量的比相等即可,极限转化后成比例的为D
本题难度:一般
2、选择题 某温度下,反应N2(g)+3H2(g) 2NH3(g);△H <0,在密闭容器中达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(H2)/c(NH3)与原平衡相比变小了,则改变条件的可能有
2NH3(g);△H <0,在密闭容器中达到平衡,平衡时改变外界条件,使反应再次平衡,新平衡时,c(H2)/c(NH3)与原平衡相比变小了,则改变条件的可能有
[? ]
A.保持容器的容积不变,升高了温度
B.保持容器压强和温度不变,向容器内补充了Ar(g)
C.保持容器容积和温度不变,向容器内补充了N2
D.保持容器容积和温度不变,液化分离走部分NH3
参考答案:C
本题解析:
本题难度:一般
3、填空题 在一定体积的密闭容器中,进行如下反应:CO2(g)+H2(g) CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表所示:
t℃
| 700
| 800
| 830
| 1000
| 1200
|
K
| 0.6
| 0.9
| 1.0
| 1.7
| 2.6
|
回答下列问题:
⑴该反应化学平衡常数的表达式:K=?;
⑵该反应为?(填“吸热”或“放热”)反应;
⑶下列说法中能说明该反应达平衡状态的是?
A、容器中压强不变? B、混合气体中c(CO)不变
C、混合气体的密度不变? D、c(CO) = c(CO2)
E、化学平衡常数K不变? F、单位时间内生成CO的分子数与生成H2O的分子数相等
⑷某温度下,各物质的平衡浓度符合下式:c(CO2)×c(H2)=c(CO)×c(H2O),试判此时的温度为?。
参考答案:⑴K=c(CO)·c(H2O)/c(CO2)·c(H2);⑵?吸热;⑶? B?⑷ 830℃
本题解析:(1)化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,所以根据反应的化学方程式可知,该反应的平衡常数K=c(CO)·c(H2O)/c(CO2)·c(H2)。
(2)根据表中数据可知,随着温度的升高,平衡常数逐渐增大,这说明升高温度平衡向正反应方向移动,因此正反应是吸热反应。
(3)在一定条件下,当可逆反应中正反应速率和逆反应速率相等时(但不为0),各种物质的浓度或含量均不再发生变化的状态,是化学平衡状态。所以B正确。该反应是体积不变的可逆反应,则压强和物质的量也是不变的,即当压强和物质的量始终是不变,A不能说明。密度是混合气的质量和容器容积的比值,在反应过程中质量和容积始终是不变的,C不正确。平衡时浓度不再发生变化,但物质之间的浓度不一定相等或满足某种关系,D不正确。平衡常数只与温度有关系,温度不变,平衡常数不变,F中反应速率的方向是相同的,速率之比是相应的化学计量数之比,因此F中的关系始终是成立,不正确,答案选B。
(4)当c(CO2)×c(H2)=c(CO)×c(H2O)时,此时K=1,所以该反应的温度是830℃.
点评:该题是高考中的常见题型,属于中等难度试题的考查,试题综合性强,在注重对学生基础知识的巩固和训练的同时,侧重对学生能力的培养和解题方法的指导与训练,有利于培养学生的逻辑推理能力和逆向思维能力,提高学生灵活运用基础知识解决实际问题的能力。该题的关键是明确平衡常数的含义以及平衡状态的判断依据,然后结合题意灵活运用即可。
本题难度:一般
4、填空题 稀土元素是宝贵的战略资源,我国的蕴藏量居世界首位。铈(Ce)是地壳中含量最高的稀土元素。在加热条件下CeCl3易发生水解。
(1)无水CeCl3可用加热CeCl3·6H2O和NH4Cl固体混合物的方法来制备。其中NH4Cl的作用是______________。
(2)在某强酸性混合稀土溶液中加入H2O2,调节pH≈3,Ce3+通过下列反应形成Ce(OH)4沉淀得以分离。完成反应的离子方程式:?
___Ce3++?___H2O2+?___H2O?→?___Ce(OH)4↓+?______
(3)在溶液中,反应A+2B C分别在三种不同实验条件下进行,它们的起始浓度均为
C分别在三种不同实验条件下进行,它们的起始浓度均为
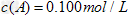 、
、 。反应物A的浓度随时间的变化如下图所示。
。反应物A的浓度随时间的变化如下图所示。
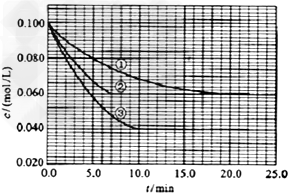
请回答下列问题:
与①比较,②和③分别仅改变一种反应条件。所改变的条件和判断的理由是:
②______________;③_______________;?实验②平衡时B的转化率为_________;实验③平衡时C的浓度为____________;该反应是________热反应,判断其理由是____________________________;该反应进行到4.0min时的平均反应速度率:实验②: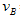 =__________________________________;
=__________________________________;
参考答案:(1)分解出HCl气体,抑制CeCl3的水解
(2)2Ce3++H2O2+6H2O→ 2Ce(OH)4↓+6H+?
(3 )②加催化剂,达到平衡的时间缩短,平衡时A的浓度未变;③温度升高,达到平衡的时间缩短,平衡时A的浓度减小;40%(或0.4);0.06mol/L; 吸热;升高温度平衡向正反应方向移动,故该反应是吸热反应;0.014mol(L·min)-1
本题解析:
本题难度:一般
5、填空题 在一固定容积为2L的密闭容器内加入0.2 mol的N2和0.6 mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g) 2NH3(g)+Q(Q>0),
2NH3(g)+Q(Q>0),
(1)该反应所用的催化剂是?(填写名称)
该反应450℃的平衡常数?500℃时的平衡常数(填“>”、“<”或“=”)。
(2)下列描述中能说明上述反应已达平衡的是?
A.3V正(H2)=2V逆(NH3)
B.容器中气体的平均分子量不随时间而变化
C.容器中气体的密度不随时间而变化
D.容器中气体的分子总数不随时间而变化