1、填空题 (14分)随着人类对温室效应和资源短缺等问题的重视,如何降低大气中CO2的含量及有效地开发利用CO2,引起了各国的普遍重视。
(1)目前工业上有一种方法是用CO2来生产燃料甲 醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应:
醇。为探究反应原理,现进行如下实验,在体积为1 L的密闭容器中,充入1mol CO2和3mol H2,在500oC下发生反应:
CO2(g)+3H2(g)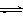 CH3OH(g)+H2O(g);△H=-49.0kJ/mol
CH3OH(g)+H2O(g);△H=-49.0kJ/mol
测得CO2和CH3OH(g)的浓度随时间变化如图所示。
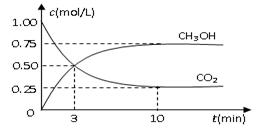
①从反应开始到平衡,氢气的平均反应速率
v(H2)=_________________________ _____;
_____;
②该反应的平衡常数K为__________ (精确到小数点后两位)。若提高温度到800oC进行达平衡时;K值__________,n(CH3OH)/n(CO2)比值__________(以上两空填“增大”、“减小”或“不变”);
(精确到小数点后两位)。若提高温度到800oC进行达平衡时;K值__________,n(CH3OH)/n(CO2)比值__________(以上两空填“增大”、“减小”或“不变”);
③平衡时CH3OH的体积分数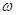 为__________;
为__________;
④若在相同条件下,起始时加入物质的量为:a mol CO2、b mol H2和c mol CH3OH、c mol H2O,达平衡后,CH3OH的体积分数仍为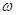 。则a、b、c的关系为__________。
。则a、b、c的关系为__________。
(2)在载人航天器的生态系统中,不仅要求分离去除CO2,还要求提供充足的O2。某种电化学装置可实现如下转化:2CO2=2CO+O2,CO可用作燃料。已知该反应的阳极反应为:4OH―-4e―=O2↑+2H2O,则阴极反应式为_________ _____________________。
_____________________。
参考答案:(1)①0.225mol/(L·min)②5.33?减小?减小
③30%?④a+c="1" b+3c=3
(2)CO2+2e-+H2O=CO+2OH-
本题解析:略
本题难度:一般
2、选择题 在密闭容器中发生反应a X(气)+b Y(气) c W(气)+d Z(气),若反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,再次达到平衡时,Z的浓度是原平衡的1.8倍,下列叙述中正确的是
c W(气)+d Z(气),若反应达到平衡后,保持温度不变,将气体压缩到原来的1/2体积,再次达到平衡时,Z的浓度是原平衡的1.8倍,下列叙述中正确的是
A.平衡向逆反应方向移动
B.a+b>c+d
C.W的体积分数增大
D.X的转化率降低
参考答案:AD
本题解析:略
本题难度:简单
3、选择题 下列说法正确的是
A.饱和氯水中加水稀释,促进氯水中水的电离
B.向氨水中加入氯化铵,由于氯化铵溶液呈酸性,所以溶液pH降低
C.碳酸钠溶液中存在CO32-+H2O  HCO3-+OH-平衡,若通入CO2,则平衡逆向移动
HCO3-+OH-平衡,若通入CO2,则平衡逆向移动
D.向氢氧化镁悬浊液中加水稀释,Mg(OH)2沉淀溶解平衡正向移动,但c(Mg2+)降低
参考答案:A
本题解析:选项B中氨水中存在以下平衡NH3·H2O = NH4 ++OH-,加入NH4 +平衡向左移动,OH-浓度降低,PH降低。选项C中CO32-+H2O===HCO3-+OH-通二氧化碳CO2+2OH-="==CO3" 2- +H2O
第二步减少了第一步的产物氢氧根,怎加了反应物碳酸根,促使第一步反应向正方向(右)移动。选项D中Mg(OH)2沉淀溶解平衡正向移动,Mg2+增加,但由于溶解度不变,c(Mg2+)不变。
点评:本题每个选项都考查了一个小的知识点,关键在于利用平衡移动的原理来解题,难度不大。
本题难度:简单
4、选择题 若15 gA物质与10.5 gB物质恰好完全反应,生成9 gC物质量和0.3 molD物质,则D物质量的摩尔质量是
A.55 g
B.55 g/mol
C.111 g/mol
D.27.5 g/mol
参考答案:B
本题解析:
本题难度:简单
5、填空题 工业上制取三氧化硫反应的热化学方程式为:
2SO2(g)十O2(g) 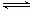 2SO3(g)?△H=-198kJ·mol-1
2SO3(g)?△H=-198kJ·mol-1
(1)能够说明在恒温恒容条件下,上述反应已经达到化学平衡状态的是?(填序号)。
A.每生成1mol SO3的同时生成0.5mol O2
B.容器中混合气体的密度不变
C.SO2、O2、SO3的物质的量之比为2:1:2
D.容器中气体总压强不变
(2)400℃,1.01×105Pa下,上述反应中n(SO3)和n(O2)随时间变化的关系如图所示。下列叙述正确的是?(填序号)。
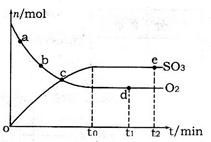
A.点a的正反应速率比点b的大
B.点c处反应达到平衡状态
C.点d和点e处的n(O2)相同
D.500℃,1.01×105Pa下,反应达到平衡时,n(SO3)比图中e点的值大
(3)已知该反应的K(400℃)=7200mol-1·L。在400℃时,容积为1.0L的密闭容器中充入0.05mol SO2(g)和0.03mol O2(g),反应一段时间后,有0.04mol SO3生成。此时,该反应?(填“是”、“否”或“无法判断”)达到化学平衡状态,理由是?。
参考答案:(1)AD(2分)(2)AC(2分)
(3)否(2分),400℃时,浓度熵Q=1600mol-1·L,而K(400℃)=7200mol-1·L,Q<K,反应没有达到平衡状态;(2分)
本题解析:(1)A、每生成1mol?SO3的同时生成0.5mol?O2,说明正逆反应速率相等,反应达到平衡状态,故A正确;B、容器是恒容的,无论反应是否达到平衡状态,混合物的质量始终不变,容器的体积不变,导致密度始终不变,所以不是达到平衡状态的标志,故B错误;C、SO2、O2与SO3的物质的量之比为2:1:2,这与反应的初始物质的量以及反应的转化程度有关,不能确定是否达到平衡,故C错误;D、该反应是一个反应前后气体体积改变的化学反应,当反应达到平衡状态时,各物质的量不变,导致容器中压强不随时间的变化而改变,故D正确;故选:AD;
(2)A.反应物浓度越大,反应速率越快,故a点时刻的正反应速率比b点时刻的大,故A正确;B.a、b、c三点未到达平衡状态,反应向正反应进行,故B错误;C.d、e两点处于平衡状态,温度相同,C(O2)相等,n(O2)相同,故C正确;D.该反应正反应是放热反应,升高温度平衡向逆反应移动,平衡时三氧化硫的物质的量减小,故D错误;故答案为:AC;
(3)? 2SO2(g)十O2(g)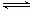 2SO3
2SO3
起始(mol/L)?0.05?0.03? 0?
反应(mol/L)?0.04?0.02?0.04
一段时间后(mol/L)0.01? 0.01? 0.04
400℃时,浓度熵Q=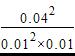 =1600mol-1·L>K(400℃)=7200mol-1·L,反应没有达到平衡。
=1600mol-1·L>K(400℃)=7200mol-1·L,反应没有达到平衡。
本题难度:困难