1、计算题 (1)某一反应体系中的物质有:HCl、SnCl2、H2SnCl6、As、H3AsO3、H2O,已知:HCl是反应物之一。
①写出并配平该反应的化学方程式:_____________________
②在该反应中,得电子的物质是______________,被氧化的元素是__________________。
③在反应中,每转移1mol电子,消耗HCl_______________mol。
(2)将2.5g碳酸钠、碳酸氢钠和氢氧化钠的固体混合物完全溶解于水,制成稀溶液,然后向该溶液中逐滴加入1mol·L-1的盐酸,所加入盐酸的体积与产生CO2的体积(标准状况)关系如下图所示:
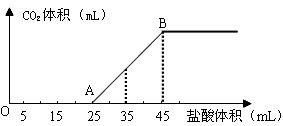
①写出OA段所发生反应的离子方程式______________________________________。
②当加入35mL盐酸时,产生CO2的体积为___________mL(标准状况)。
2、填空题 反应5NH4NO3=4N2+2HNO3+9H2O中被氧化的N与被还原的N的个数比是______;电子转移的总数是______.
3、填空题 蓄电池是一种可以反复充电、放电的装置。有一种蓄电池在充电和放电时发生的反应是:
NiO2+Fe+2H2O Fe(OH)2+Ni(OH)2
Fe(OH)2+Ni(OH)2
(1)若此蓄电池放电时,该电池某一电极发生还原反应的物质是________(填序号)。
A.NiO2 B.Fe C.Fe(OH)2 D.Ni(OH)2
(2)用此蓄电池分别电解以下两种溶液,假如电路中转移了0.02 mol e-,且电解池的电极均为惰性电极,
试回答下列问题:
①电解M(NO3)x溶液时某一电极增加了a g M,则金属M的相对原子质量为____________(用含“a、x”的表达式表示)。
②电解含有0.01 mol CuSO4和0.01 mol NaCl的混合溶液100 mL,阳极产生的气体在标准状况下的体积是________L;将电解后的溶液加水稀释至1 L,此时溶液的pH=____________________。
4、简答题 KMnO4溶液与浓HCl反应,可生成Cl2:2KMnO4+16HCl=2KCl+2MnCl2+5Cl2↑+8H2O若生成71克氯气,需参加反应的氯化氢为多少克?被氧化的氯化氢是多少克?
5、选择题 P单质在反应4P+3KOH+3H2O=3KH2PO2+PH3中
A.被氧化
B.被还原
C.既被氧化又被还原
D.既未被氧化又未被还原