1、选择题 在2L密闭容器中,加入X和Y各4mol,一定条件下发生化学反应:2X(g)+ 2Y(g) Z(g)+2W(g) △H<0,反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是
Z(g)+2W(g) △H<0,反应进行到5s时测得X的转化率为25%,10 s后达到化学平衡,测得Z的浓度为0.5mol/L,则下列说法正确的是
A.5s内平均反应速率为υ(Y)=" 0.2" mol/( L·s)
B.该反应的平衡常数数值为0.5
C.保持容积体积不变,向容器中通入惰性气体可提高反应物的转化率
D.升高温度,当测得容器中密度不变时,表示该反应已经达到平衡状态
参考答案:B
本题解析:根据方程式:2X(g)? + 2Y(g)? ?Z(g)? +? 2W(g) △H<0
?Z(g)? +? 2W(g) △H<0
起始物质的量 4? 4? 0? 0
5s变化物质的量 4×25%? 4×25%? 2×25%? 4×25%
10s变化物质的量2? 2?0.5×2? 2
10s平衡物质的量? 2? 2? 1? 2
5s内平均反应速率为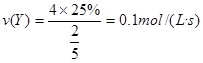 ,A错;
,A错;
平衡常数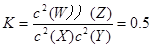 ,B对
,B对
保持容积体积不变,向容器中通入惰性气体,表面上容器内压强增大,但体系中各组分的浓度保持不变,平衡并不会发生移动,转化率不变,C错。
在恒容密闭容器中,由于反应物和生成物的状态都是气态,不管平衡于否,体系内的密度都保持不变D错。
本题难度:一般
2、选择题 用锌粒与稀盐酸反应制取氢气时,下列措施不能使氢气的生成速率增大的是(? )
A.升高反应体系的温度
B.增加锌粒的用量
C.不用锌粒,改用锌粉
D.加入少量的浓硫酸
参考答案:B
本题解析:因为锌粒为固体,固体浓度是常数,在固体表面积不变的情况下,增加固体用量,不会增大反应速率。
本题难度:一般
3、选择题 一定温度下,反应H2(g)+X2(g)?2HX(g)的平衡常数为64,将2molH2和2molX2通入体积为1L的密闭容器中,该温度下H2的平衡转化率为( )
A.20%
B.40%
C.60%
D.80%
参考答案:设得到平衡时氢气的转化率为x,
反应方程式 H2(g)+X2(g)?2HX(g)
反应前 2mol 2mol 0
变化2xmol 2xmol 4xmol
平衡状态2mol-2xmol 2mol-2xmol 4xmol
该温度下,平衡常数K=(4x1)2(2-2x1)?(2-2x1)=64,
解得x=43(舍弃)或x=0.8,
所以D正确,
故选:D.
本题解析:
本题难度:简单
4、选择题 当密闭容器中反应:mA(g)+nB(s) PC(g)达到化学平衡时,缩小密闭容器的体积,发现A的转化率降低,下列关系普遍运用于上述一类反应的是(?)
PC(g)达到化学平衡时,缩小密闭容器的体积,发现A的转化率降低,下列关系普遍运用于上述一类反应的是(?)
A.m+n>p
B.m+n<p
C.m<p
D.m>P
参考答案:C
本题解析:由缩小密闭容器的体积,发现A的转化率降低,说明加压,平衡向逆反应方向移动,则m<p,特别注意物质B的状态是固态。
本题难度:一般
5、计算题 将10molA和5molB放入10L的真空箱中,某温度下发生反应: 3A(气)+B(气)==2C(气)在最初0.2s内,消耗A的平均速率为0.06mol/L·s,则在0.2s时,箱中有________molC生成。
参考答案:0.08
本题解析:
本题难度:一般