1、推断题 A、B、C是中学化学常见物质,含有同一种元素。其转化关系如下
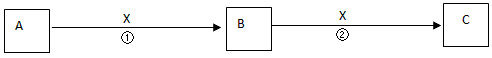
(1)若X为无色无味的气体,是一种常用氧化剂。A为气体化合物,溶于水后所得溶液使红色石蕊试纸呈蓝色。该转化关系是工业制硝酸的反应原理。则A的电子式是________________。
(2)若X为还原剂。将5~6滴A的饱和溶液滴入沸水中,可得到红褐色液体,该液体能产生丁达尔效应。反应②的离子方程式为________________。
(3)若X为一种常见的碱,A、C均为盐,B为白色胶状沉淀,几乎不溶于水,但能凝聚水中的悬浮物。已知Na2S溶液显碱性,向A的溶液中加入Na2S溶液,生成具有臭鸡蛋气味的气体H2S,反应的离子方程式为_____________________。
参考答案:(1)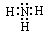
(2)Fe2+ + Zn = Zn2+ + Fe
(3)2Al3+ + 3S2- + 6H2O == 3H2S↑+ 2Al(OH)3↓
本题解析:
本题难度:一般
2、填空题 由熔盐电解法获得的粗铝含有一定量的金属钠和氢气,这些杂质可采用吹气精炼法除去。
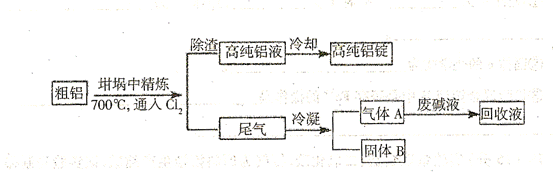
(注:NaCl熔点为801℃;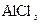 在181℃升华)
在181℃升华)
(1) 精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①?
精炼前,需清除坩埚表面的氧化铁和石英砂,防止精炼时它们分别与铝发生置换反应产生新的杂质,相关的化学方程式为①? ?和②?。?
?和②?。?
(2)将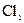 连续通人坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除
连续通人坩埚中的粗铝熔体,杂质随气泡上浮除去。气泡的主要成分除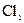 外还含有?,固态杂质粘附于气泡上,在熔体表面形定浮渣,浮渣中肯定存在?。
外还含有?,固态杂质粘附于气泡上,在熔体表面形定浮渣,浮渣中肯定存在?。
(3)在用废碱液处理A的过程中,所发生反应的离子方程式为?
?。
参考答案:(1)① (2分)
(2分)
② (2分)
(2分)
(2)HCl和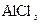 (1分)?
(1分)?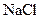 (1分)
(1分)
 (2分)?
(2分)?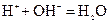 (2分)
(2分)
本题解析:略
本题难度:一般
3、选择题 下列有关物质的性质或应用均正确的是
A.Si是一种非金属主族元素,其氧化物可用于制作计算机芯片
B.氢氧化镁分解时吸收大量的热量,添加到合成树脂中可作阻燃剂
C.铁具有良好的导电性,氯碱工业中可用铁作阳极电解食盐水
D.用二氧化硫加工银耳,使之更白
参考答案:B
本题解析:A、硅的氧化物二氧化硅用是制造光导纤维的材料,错误;B、氢氧化镁分解时吸收大量的热量,使周围温度降低,添加到合成树脂中可作阻燃剂,正确;C、氯碱工业中的阳极不能是铁,铁作阳极,则铁发生氧化反应,而不是氯离子,得不到氯气,错误;D、二氧化硫有毒,对人体有害,不能用在食品加工,错误,答案选B。
本题难度:一般
4、选择题 下列物质中,不能与氢氧化钠溶液发生反应的是( )
A.Mg
B.Al?(OH)3
C.Al
D.CO2
参考答案:A、Mg不能与氢氧化钠溶液反应,故A符合;
B、氢氧化铝是两性氢氧化物,与氢氧化钠反应生成偏铝酸钠与水,故B不符合;
C、Al与氢氧化钠反应生成偏铝酸钠、氢气,故C不符合;
D、二氧化碳是酸性氧化物,与氢氧化钠碱反应生成碳酸钠与水,故D不符合.
故选:A.
本题解析:
本题难度:一般
5、选择题 100ml 1mol/L的AlCl3溶液与100ml?3.5mol/L的NaOH溶液混合,得到沉淀为(?)
A.7.8g
B.0g
C.91 g
D.19.5g
参考答案:D
本题解析:AlCl3+3NaOH=Al(OH)3+3NaCl,可知0.1molAlCl3只消耗0.3molNaOH,余下的0.05molNaOH发生反应Al(OH)3+NaOH=NaAlO2+2H2O,计算得出会溶解0.05mol Al(OH)3,所以最终只得到0.3-0.05=0.25mol沉淀,0.25*78=19.5g
本题难度:简单