1、选择题 已知t℃下Na2SO3的溶解度是S?g.一定质量的Na2SO3溶液加入ag?Na2SO3,在t℃恰好饱和.若以Na2SO3?7H2O代替Na2SO3,也使原溶液在t℃恰好饱和,需加入Na2SO3?7H2O(摩尔质量为252g?mol-1)的质量是( )
A.
g
B.g
C.g
D.g
参考答案:设需Na2SO3?7H2O的质量为x,则Na2SO3?7H2O中含Na2SO3和H2O质量相等均为0.5x,据题意可得:0.5x-a0.5x=S100,则x=200a100-Sg.
故选B.
本题解析:
本题难度:简单
2、选择题 X、Y、Z三种气体,取X和Y按1:1的物质的量之比混合,放入密闭容器中发生如下反应:X+2Y 2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于 ( )
2Z,达到平衡后,测得混合气体中反应物的总物质的量与生成物的总物质的量之比为3:2,则Y的转化率最接近于 ( )
A.33%
B.40%
C.50%
D.66%
参考答案:D
本题解析:? X+2Y 2Z
2Z
起始量(mol)? 1? 1? 0
转化量(mol)? x? 2x? 2x
平衡量(mol) 1-x 1-2x? 2x
则根据题意可知(1-x+1-2x):2x=3:2
解得x=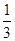
所以Y的转化率是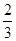 ,答案选D。
,答案选D。
点评:该题是高考中的常见题型,属于基础性试题的考查。试题难易适中,贴近高考,主要是考查学生灵活运用基础知识解决实际问题的能力。该题试题相应注意的是在进行可逆反应的有关计算时,一般采用“三段式”进行,即分别列出起始量、转化量和平衡量或某深刻的量,然后依据已知条件列式计算即可。
本题难度:简单
3、选择题 有K2SO4和Al2(SO4)3的混合溶液,已知其中Al3+的物质的量浓度为0.4mol/L,SO42-的物质的量浓度为0.7mol/L,则此溶液中K+的物质的量浓度为( )
A.0.1mol/L
B.0.15mol/L
C.0.2mol/L
D.0.25mol/L
参考答案:溶液呈电中性,则满足:3c(Al3+)+c(K+)+c(H+)=2c(SO42-)+c(OH-),
由于溶液中c(H+)和c(OH-)很小,可忽略不计,则有3c(Al3+)+c(K+)=2c(SO42-),
所以有3×0.4mol/L+c(K+)=2×0.7mol/L,
c(K+)=2×0.7mol/L-3×0.4mol/L=0.2mol/L,
故选C.
本题解析:
本题难度:简单
4、计算题 工业上用丁烷氧化法制醋酸,反应的化学方程式可表示为:
2C4H10+5O2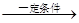 4CH3COOH+2H2O
4CH3COOH+2H2O
现用58吨丁烷为原料制取醋酸,求:
(1)理论上需要标准状况下的空气?m3(设空气中O2、N2的体积分数分别为0.2、0.8),同时生成水?吨。
(2)若生成的醋酸溶解在生成的水中,所得醋酸的质量分数为?%。
(3)若同时生产质量分数为100%的冰醋酸m1吨和质量分数为50%的醋酸m2吨,且 ,需补充水y吨,则y与x的关系式为?(用含x的代数式表示y);若不补充水,则m1+m2=?。
,需补充水y吨,则y与x的关系式为?(用含x的代数式表示y);若不补充水,则m1+m2=?。
参考答案:(5分)(1)2.8×105 ;18(2)86.96%(3) ?;138;每空1分
?;138;每空1分
本题解析:(1)令O2需要的物质的量为xmol
则2C4H10+5O2=4CH3COOH+2H2O
58×2g?5mol
58×106?xmol
解得x=2.5×106mol
所以需要空气的体积为(2.5×106
令生成水y吨,则:
2C4H10+5O2=4CH3COOH+2H2O
58×2g?18×2g
58吨?y吨
所以y=18吨
(2)令生成醋酸m吨,则
2C4H10+5O2=4CH3COOH+2H2O
58×2g?4×60g
58吨?m吨
所以m=120吨
由(1)中计算可知,生成水18吨,生成的醋酸溶解在生成的水中,所得醋酸的质量分数为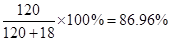
(3)由题意可知,m1+50%×m2=120
若需补充水y吨,则50%×m2=8+y
所以m2=36+2y
则m1=120-18-y=102-y
即102-y=x(36+2y)
即
若不补充水,50%×m2=18
所以m2=36
故m1=120-50%×m2=102
所以m1+m2=36+102=138
故y=138
点评:该题是高考中的常见题型,属于中等难度的试题。试题贴近高考,综合性强,旨在培养学生分析、归纳和总结问题的能力,有利于调动学生的学习兴趣,激发学生的学习积极性。也有助于培养学生的逻辑推理能力和规范的答题能力。
本题难度:一般
5、选择题 下列溶液中物质的量浓度为1mol/L的是 ( )
A.将40gNaOH固体溶解于1L水中
B.将22.4L氯化氢气体溶于水配成1L溶液
C.将1L 10 mol/L的浓盐酸与9L水混合
D.10gNaOH固体溶解在水中配成250mL溶液