1、选择题 下列微粒中,与NH4+具有相同的质子数和相同电子数的是( )
A.F
B.NH3
C.CH4
D.Na+
参考答案:D
本题解析:
本题难度:一般
2、简答题 铜锰氧化物(CuMn2O4)能在常温下催化氧化空气中的一氧化碳和甲醛(HCHO).
(1)锰元素位于第四周期,第ⅦB族.请写出Mn2+基态的电子排布式______.NO3-的空间构型为______(用文字描述).
(2)CO和N2的结构相似,CO的结构式为______.HCHO中含有的σ键和π键数目比为______.
(3)火山喷出岩浆中含有多种硫化物.冷却时ZnS比HgS先析出,原因是______.
(4)Cu3N形成的晶体结构如图所示.与同一个N3-相连的Cu+有______个.

参考答案:(1)Mn的原子序数为25,基态原子的电子排布式为,1s22s22p63s23p63d54s2,则Mn2+基态的电子排布式可表示为1s22s22p63s23p63d5(或[Ar]3d5),NO3-中N原子形成3个δ键,没有孤电子对,则应为平面三角形,
故答案为:1s22s22p63s23p63d5;平面三角形;
(2)N2与CO为等电子体,二者结构相似,N2的结构为N≡N,则CO的结构为C≡O,
甲醛的结构式为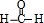 ,分子中含有2个C-H键、1个C=O键,单键为σ键,双键中具有1个σ键、1π键,故分子中σ键和π键数目比为3:1;
,分子中含有2个C-H键、1个C=O键,单键为σ键,双键中具有1个σ键、1π键,故分子中σ键和π键数目比为3:1;
故答案为:C≡O;3:1;
(3)二者均为离子晶体,ZnS晶格能大于HgS,因此ZnS先析出,故答案为:二者均为离子晶体,ZnS晶格能大于HgS,因此ZnS先析出;
(4)晶胞中黑色球数目为12×14=3,白色球数目为8×18=1,故黑色球为Cu+,白色球为N3-,由晶胞结构可知,棱上的Cu+与N3-相连,以N3-为中心,在X、Y、Z三个轴上,在每个轴上等距离的Cu+有2个,故同一个N3-相连的Cu+有6个,故答案为:6.
本题解析:
本题难度:一般
3、简答题 [化学--物质结构与性质]
Q、R、X、Y、Z五种元素的原子序数依次递增.已知:
①Z的原子序数为29,其余的均为短周期主族元素;
②Y原子价电子(外围电子)排布msnmpn
③R原子核外L层电子数为奇数;
④Q、X原子p轨道的电子数分别为2和4.
请回答下列问题:
(1)Z2+的核外电子排布式是______.
(2)在[Z(NH3)4]2+离子中,Z2+的空间轨道受NH3分子提供的______形成配位键.
(3)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是______.
a.稳定性:甲>乙,沸点:甲>乙?b.稳定性:甲>乙,沸点:甲>乙
c.稳定性:甲<乙,沸点:甲<乙?d.稳定性:甲<乙,沸点:甲>乙
(4)Q、R、Y三种元素的第一电离能数值由小到大的顺序为______(用元素符号作答)
(5)Q的一种氢化物相对分子质量为26,其中分子中的σ键与π键的键数之比为______.
(6)五种元素中,电负性最大与最小的两种非金属元素形成的晶体属于______.
参考答案:由29号为Cu元素.Y价电子:msnmpn中n只能取2,又为短周期,则Y可能为C或Si.R的核外L层为奇数,则可能为Li、B、N或F.Q、X的p轨道为2和4,则C(或Si)和O(或S).又五种元素原子序数依次递增.所以可推出:Q为C,R为N,X为O,Y为Si.
(1)Cu的价电子排布为3d104s1,失去两个电子,则为3d9,故答案为:1s22s22p63s23p63d9;
(2)Cu2+可以与NH3形成配合物,其中NH3中N提供孤对电子,Cu2+提供空轨道,而形成配位键,故答案为:孤对电子(孤电子对);
(3)Q、Y的氢化物分别为CH4和SiH4,由于C的非金属性强于Si,则稳定性CH4>SiH4.因为SiH4?的相对分子质量比CH4大,故分子间作用力大,沸点高,故答案为:b;
(4)C、N和Si中,C、Si位于同一主族,则上面的非金属性强,故第一电离能大,而N由于具有半充满状态,故第一电离能比相邻元素大,所以N>C>Si,故答案为:Si<C<N;
(5)C、H形成的相对分子质量为26的物质为C2H2,结构式为H-C≡C-H,C-H之间单键是σ键,C≡C叁键中有两个是σ键一个π键,所以σ键与π键数之比为3:2,故答案为:3:2;
(6)电负性最大的非元素是O,最小的非金属元素是Si,两者构成的SiO2,构成微粒是原子,作用力是共价键,则属于原子晶体,故答案为:原子晶体.
本题解析:
本题难度:一般
4、填空题 铜(Cu)是重要金属,Cu的化合物在科学研究和工业生产中具有许多用途,如CuSO4溶液常用作电解液、电镀液等。请回答下列问题:
(1)CuSO4可由金属铜与浓硫酸反应制备,该反应的化学方程式为__________________;
(2)CuSO4粉末常用来检验一些有机物的微量水分,其原因是__________________;
(3)SO42-的立体构型是__________,其中S原子的杂化轨道类型是___________;
(4)元素金(Au)处于周期表中的第六周期,与Cu同族,Au原子最外层电子排布式为___________;一种铜金合金晶体具有立方最密堆积的结构,在晶胞中Cu原子处于面心、Au原子处于顶点位置,则该合金中Cu原子与Au原子数量之比为________;该晶体中,原子之间的作用力是__________;
(5)上述晶体具有储氢功能,氢原子可进入到由Cu原子与Au原子构成的四面体空隙中。若将Cu原子与Au原子等同看待,该晶体储氢后的晶胞结构与CaF2的结构相似,该晶体储氢后的化学式应为___________。
参考答案:(1)Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O
CuSO4+SO2↑+2H2O
(2)无水硫酸铜可与水结合生成蓝色的CuSO4·5H2O,因而通过观察可得结论
(3)正四面体;sp3
(4)5d106s1;3:1;金属键
(5)H4AuCu3
本题解析:
本题难度:一般
5、选择题 下列说法正确的是( )
A.因为p轨道是“8”字形的,所以p电子走“8”字形
B.第三电子层,有3s、3p、3d三个轨道
C.原子轨道与电子云都是用来形象描述电子运动状态
D.氢原子中只有一个电子,故氢原子只有一个轨道
参考答案:C
本题解析:
本题难度:简单