| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《物质的量》高频试题特训(2019年最新版)(十)
参考答案:B 本题解析: 本题难度:简单 2、选择题 NA代表阿伏加德罗常数,下列说法正确的是 ( ) |
参考答案:B
本题解析:略
本题难度:简单
3、选择题 某温度下,V?mL不饱和NaNO3溶液a?g,蒸发掉b?g水或加入b?g?NaNO3固体(恢复到原温度)均可使溶液达到饱和,则下列量的计算结果正确的是
[? ]
A.该温度下NaNO3的溶解度为100?g
B.原不饱和溶液中NaNO3的质量分数为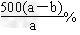
C.原不饱和溶液中NaNO3的物质的量浓度为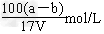
D.原不饱和溶液的密度为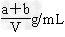
参考答案:AC
本题解析:
本题难度:一般
4、选择题 下列溶液中有关物质的量浓度关系正确的是( )
A.pH相等的CH3COONa、NaOH和Na2CO3三种溶液:[NaOH]<[CH3COONa]<[Na2CO3]
B.Na2CO3溶液中[Na+]与[CO32-]之比为2:1
C.[NH4+]相等的NH4Cl和NH4HCO3、NH4HSO4三种溶液:[NH4HSO4]<[NH4Cl]<[NH4HCO3]
D.橙汁、人体血液、蔗糖溶液、胃液中[H+]依次降低
参考答案:A、强碱弱酸盐,对应酸的酸性越弱,水解程度越大,溶液中溶质的物质的量越小,酸性大小关系为:醋酸>碳酸,所以碳酸钠水解程度大,pH相同时,醋酸钠的浓度大于碳酸钠的浓度;氢氧化钠为强碱,浓度最小,所以pH相同,三者浓度关系为:[NaOH]<[Na2CO3]<[CH3COONa],故A错误;
B、碳酸钠溶液中,由于碳酸根离子发生了水解,物质的量减小,所以[Na+]与[CO32-]之比大于2:1,故B错误;
C、氯化铵属于弱酸弱碱盐、碳酸氢铵属于弱酸弱碱盐,发生双水解,水解程度增大、碳酸氢铵溶液显示酸性,溶液中的氢离子抑制了铵离子水解,所以溶液中铵离子浓度相等,三种溶液浓度满足::[NH4HSO4]<[NH4Cl]<[NH4HCO3],故C正确;
D、血液:7.35~7.45、胃液:0.9~1.5、橙汁显示弱酸性,pH在3.5左右、蔗糖呈中性,所以氢离子浓度为:胃液>橙汁>蔗糖>血液,故D错误;
故选C.
本题解析:
本题难度:简单
5、选择题 下列说法中正确的是 ( )
A.1 L水中溶解了58.5 g NaCl,该溶液的物质的量浓度为1 mol·L-1
B.从1 L 2 mol·L-1的H2SO4溶液中取出0.5 L,该溶液的浓度为1 mol·L-1
C.配制500 mL 0.5 mol·L-1的CuSO4溶液,需62.5 g胆矾
D.中和100 mL 1 mol·L-1的H2SO4溶液,需NaOH 4 g
参考答案:C
本题解析: A项58.5 g NaCl溶于1 L水后所得溶液的体积不再是1 L,其浓度不是1 mol·L-1;B项取出的部分溶液浓度仍为2 mol·L-1;D项中和100 mL
1 mol·L-1的H2SO4溶液,需0.2 mol NaOH,质量为8 g。
考点:溶液的配制及分析
本题难度:一般
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点总结《物质的量》.. | |