1、选择题 常温下,Ag2SO4、AgCl、AgI的溶度积常数依次为:Ksp(Ag2SO4)=7.7×10-5mol3/L3、Ksp(AgCl)=
1.8×10-10 mol2/L2、Ksp(AgI)=8.3×10-17 mol2/L2。下列有关说法中,错误的是
[? ]
A.常温下,Ag2SO4、AgCl、AgI在水中溶解能力依次减小
B.在AgCl饱和溶液中加入NaI固体,有AgI沉淀生成
C.Ag2SO4、AgCl、AgI的溶度积常数之比等于它们饱和溶液的物质的量浓度之比
D.在Ag2SO4饱和溶液中加入Na2SO4固体有Ag2SO4沉淀析出
参考答案:C
本题解析:
本题难度:一般
2、选择题 纯净的NaCl并不潮解,但家庭所用的食盐因含有MgCl2杂质而易于潮解.为得到纯净的氯化钠,有人设计这样方法:把买来的食盐放入纯NaCl的饱和溶液中一段时间,过滤即得纯净的NaCl固体,对此有下列说法,其中正确的是( )
A.食盐颗粒大一些有利于提纯
B.设计实验的根据是MgCl2比NaCl易溶于水
C.设计实验的根据是NaCl的溶解平衡
D.在整个过程中,溶液中NaCl的物质的量浓度会变大
参考答案:A、NaCl固体在NaCl饱和溶液中的溶解是一种动态平衡,食盐颗粒小一些能加快溶解和析出的速率,有利于提纯.故A错误;
?B、设计实验的根据是NaCl固体在NaCl饱和溶液中的溶解不在增加,而MgCl2在NaCl饱和溶液中溶解未达到饱和,因此
MgCl2溶解只剩下纯净的NaCl.故B错误;
C、在饱和NaCl溶液中,NaCl固体的溶解处于平衡状态,溶解和析出同时存在,NaCl溶解的量不会再增加,但对于MgCl2并未达到饱和,因此最后的固体中只会存在NaCl.故C正确;
D、NaCl溶液已达到饱和,浓度不可能变大.故D错误.
故选C.
本题解析:
本题难度:简单
3、选择题 下列有关实验原理或实验操作正确的是( )
A.用蒸馏水湿润的pH试纸测量某溶液的pH=10
B.用10?mL量筒量取0.5000?mol?L-1H2SO4溶液5.50?mL
C.向铁钉上镀铜时,铁钉连接直流电源的正极
D.向AgCl沉淀中滴加KI溶液,白色沉淀转化为黄色
参考答案:A.测定pH的方法是:用玻璃棒蘸取待测溶液,滴在试纸上,然后再与标准比色卡对照,便可测出溶液的pH.pH试纸先用蒸馏水润湿,这样的操作会使溶液变稀,故A错误;
B.用10?mL量筒量取H2SO4溶液5.50?mL,无法实现,因量筒的精确度只有0.1mL,故B错误;
C.根据电解的原理,电解池的阳极需与原电池的正极相连,阳极溶解,在阴极析出,所以在铁钉上镀铜,需阳极为铜,阴极为铁,故C错误;
D.向AgCl沉淀中滴加KI溶液,白色沉淀转化为黄色沉淀.说明相同体积的溶液中溶解的氯化银的物质的量多,溶解碘化银的物质的量少,即Ksp(AgCl)>Ksp(AgI),故D正确;
故选D.
本题解析:
本题难度:一般
4、选择题 下列说法正确的是( )
A.升高温度,AgCl的溶解度增大,Ksp不变
B.物质的溶解度随温度的升高而增加,故物质的溶解都是吸热的
C.向AgCl饱和溶液中加入NaCl固体,AgCl的溶解度和Ksp都不变
D.用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小
参考答案:A、Ksp与温度有关,所以升高温度,AgCl的溶解度增大,Ksp也增大,故A错误;
B、物质的溶解度不一定随温度的升高而增大,如氢氧化钙溶液随温度的升高溶解度减小,故B错误;
C、氯化银饱和溶液中存在沉淀溶解平衡,向AgCl饱和溶液中加入NaCl固体,则平衡向生成沉淀的方向进行,氯化银的溶解度减小,Ksp只随温度的变化而变化,所以Ksp不变,故C错误;
D、氯化银饱和溶液中存在沉淀溶解平衡,氯离子浓度增大,平衡向生成沉淀方向进行,所以用稀盐酸洗涤AgCl沉淀比用水洗涤损耗AgCl小,故D正确;
故选D.
本题解析:
本题难度:简单
5、填空题 (8分)氢氧化铜悬浊液中存在如下平衡:Cu(OH)2(s)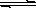 Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。
Cu2+(aq)+2OH-(aq),常温下其Ksp=c(Cu2+)· c2(OH-)=2×10-20mol2·L-2。
(1)某硫酸铜溶液里c(Cu2+)=0.02mol/L,如要生成Cu(OH)2沉淀,应调整溶液pH使之大于 。
(2)要使0.2mol/L硫酸铜溶液中Cu2+沉淀较为完全(使Cu2+浓度降至原来的千分之一),则应向溶液里加入氢氧化钠溶液使溶液pH为 。
参考答案:(1)5?(2)6
本题解析:考查溶度积常数和pH的有关计算。
(1)根据氢氧化铜的溶度积常数表达式可知 ,所以氢离子浓度为10-5mol/L,因此pH等于5。
,所以氢离子浓度为10-5mol/L,因此pH等于5。
(2)Cu2+浓度降至原来的千分之一后,铜离子的浓度变为2×10-4mol/L,所以根据氢氧化铜的溶
度积常数表达式可知
所以氢离子浓度为10-6mol/L,因此pH等于6。
本题难度:简单