1、填空题 (4分)氮可以形成多种离子,如N3-、NH、N、NH、N2H、N2H等,已知N2H与N2H是由中性分子结合质子形成的,类似于NH,因此有类似于NH的性质。
(1) NH的电子式为____________。(2)N有______个电子。
(3)写出两种由多个原子组成的含有与N电子数相同的物质的化学式__________。
(4)等电子数的粒子往往具有相似的结构,试预测N的空间构型________________。
参考答案:(1)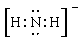 ? (2)22? (3)CO2、N2O (4)直线形
? (2)22? (3)CO2、N2O (4)直线形
本题解析:(1)NH是10电子的阴离子,其电子式为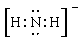 。
。
(2)由于是阴离子,所以N中含有的电子数是7×3+1=22。
(3)根据电子是22个可知,化合物的化学式可以是CO2、N2O等。
(4)CO2是直线型结构,所以根据等电子数的粒子往往具有相似的结构可知,N的空间构型是直线型。
本题难度:一般
2、选择题 下列关于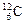 、
、 、
、 的说法正确的是(?)
的说法正确的是(?)
A.它们的化学性质相似
B.它们是碳元素的三种同位素
C.它们是碳元素的三种单质
D.它们是碳元素的同素异形体
参考答案:B
本题解析:略
本题难度:简单
3、推断题 原子序数由小到大排列的四种短周期元素X、Y、Z、W,四种元素的原子序数之和为 32,在周期表中X是原子半径最小的元素,Y、Z左右相邻,Z、W位于同主族。请回答下列问题:
(1) X、Y、Z、W四种元素的原子半径由大到小的排列顺序是_______ (用元素符号表示)。
(2) 由X、Y、Z、W四种元素中的三种组成的一种强酸,该强酸的稀溶液能与铜反应,离子方程式为 _______。
(3) 由X、Y、Z、W四种元素组成的一种离子化合物A:
①已知1 mol A能与足量的NaOH浓溶液反应生成标准状况下44.8L气体。写出加热条件下A与NaOH溶液反应的离子方程式_______ ;
②又知A既能与盐酸反应,又能与氯水反应,写出A与足量盐酸反应的离子方程式_______;
(4) 由X,Y,Z,W和Fe五种元素组成的式量为392的化合物B,1mol B中含有6mol结晶水。对化合物B进行如下实验:
a.取B的溶液加入过量浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体。 过一段时间白色沉淀变成灰绿色,最终变成红褐色;b.另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解。
①B的化学式为_______
②B溶液中的离子浓度由大到小的顺序为:_______
参考答案:(8分) (1)? S> N > O >H?(2分) ;
(2)? 3Cu+8H++2NO3- =3Cu2+ +2NO↑+4H2O?(1分);
(3)①? NH4++OH- NH3↑+H2O?(1分);
NH3↑+H2O?(1分);
② SO32-+2H+ =H2O+SO2↑(1分);
(4)①(NH4)2Fe(SO4)2·6H2O (2分) ;
②c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) >c(OH-)?(1分)
本题解析:原子序数由小到大排列的四种短周期元素X、Y、Z、W,在周期表中X是原子半径最小的元素,则X为H元素;Z、W位于同主族,设Z的原子序数为x,则W的原子序数为x+8,Y、Z左右相邻,Y的原子序数为x-1,由四种元素的原子序数之和为32,则1+(x-1)+x+(x+8)=32,解得x=8,即Y为N元素,Z为O元素,W为S元素。
(1) X为H元素,Y为N元素,Z为O元素,W为S元素,依据元素周期律分析,原子半径由大到小的排列顺序是S> N > O >H。
(2)和铜反应的酸一般是浓硫酸、稀硝酸和浓硝酸,由X、Y、Z、W四种元素中的三种组成的一种强酸为稀硝酸,稀硝酸与铜反应的离子方程式为3Cu+8H++2NO3- =3Cu2+ +2NO↑+4H2O。
(3) ①与NaOH浓溶液反应生成气体的A物质中含有铵根,故加热条件下A与NaOH溶液反应的离子方程式为NH4++OH- NH3↑+H2O。
NH3↑+H2O。
②A既能与盐酸反应,又能与氯水反应说明A中含有具有还原性的离子,故A与足量盐酸反应的离子方程式SO32-+2H+ =H2O+SO2↑。
(4)①B能与浓NaOH溶液并加热,产生白色沉淀和无色刺激性气味气体,说明B中含有铵根离子,过一段时间白色沉淀变成灰绿色,最终变成红褐色,说明B中含有亚铁离子。另取B的溶液,加入过量BaCl2溶液产生白色沉淀,加盐酸沉淀不溶解,说明B中含有硫酸根离子,再结合式量为392的化合物B,1mol B中含有6mol结晶水,故B的化学式为(NH4)2Fe(SO4)2·6H2O。①B溶液中的离子浓度由大到小的顺序为c(SO42-)>c(NH4+)>c(Fe2+)>c(H+) >c(OH-)。
点评:本题考查位置、结构、性质的关系、常用化学用语,明确Y、Z、W的位置及原子序数的关系来推断元素是解答本题的关键,难度不大。
本题难度:一般
4、计算题 (9分)将主族元素X的最高价氧化物X2O 4.7 g溶于95.3 g水中,所得溶液中溶质的质量分数为5.6%。Y与X在周期表中位于同一主族,Y的氢氧化物12 g与400 mL 0.75 moL·L-1的盐酸恰好中和。Z与Y在周期表中位于同一周期,标准状况下5.6 L ZO2气体的质量为16 g。求X、Y、Z的相对原子质量。并分别写出它们原子的电子式。
参考答案:X、Y、Z的相对原子质量分别为:39,23,32,电子式分别为K·,Na·, 。
。
本题解析:设X的相对原子质量为M(X),Y的相对原子质量为M(Y)。
由? X2O+H2O====2XOH
2M(X)+16?2×[M(X)+17]
47 g? (4.7+95.3)×5.6% g
即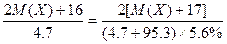 ,M(X)=39,X为钾元素;
,M(X)=39,X为钾元素;
又已知n(HCl)="0.75" mol·L-1×0.40 L="0.30" mol则
YOH+HCl====YCl+H2O
M(Y)+17? 1 mol
12 g?0.30 mol
∴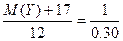 ,M(Y)=23,Y为钠元素;
,M(Y)=23,Y为钠元素;
ZO2的摩尔质量为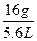 ×22.4 L·mol-1="64" g·mol-1,即ZO2相对分子质量为64,M(Z)="64-16×2" =32,Z为硫元素。则X的相对原子质量为39,电子式为K·;Y的相对原子质量为23,电子式为Na·;Z的相对原子质量为32,电子式为
×22.4 L·mol-1="64" g·mol-1,即ZO2相对分子质量为64,M(Z)="64-16×2" =32,Z为硫元素。则X的相对原子质量为39,电子式为K·;Y的相对原子质量为23,电子式为Na·;Z的相对原子质量为32,电子式为 。
。
本题难度:简单
5、填空题 (1)R+与S2–所含电子数相同,则R元素的原子序数为?
(2)一种基于酸性燃料电池原理设计的酒精检测仪,正极上的反应为:O2 + 4e– + 4H+ ?= 2H2O,检测有酒精时,电解质溶液中的H+向?极移动,该电池负极上的反应为: ?
(3)X、Y、Z、M、G五种分属三个短周期主族元素,且原子序数依次增大。Z存在质量数为23,中子数为12的核素A;Y、M同主族,可形成MY2、MY3两种分子。
回答下列问题:
①用化学符号表示核素A:?;
②上述元素的最高价氧化物对应的水化物酸性最强的是?(写化学式),写出该物质与氢氧化钠溶液反应的离子方程式:?;
③X2M的电子式为?;
④ZG用途广泛,下列说法正确的是:?。
A.作调味剂
B.用于食物防腐
C.用于氯碱工业
D.用于医疗
参考答案:(1)19?(2)正? CH?3CH2OH – 4e– + H2O = CH3COOH + 4H+
(3) ①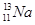 ?② HClO4? OH– + H+ ?= H2O
?② HClO4? OH– + H+ ?= H2O
③ ?④ ABCD
?④ ABCD
本题解析:(1)S2–所含电子数为18,则R所含电子数为18+1=19,故其原子序数为19。
(2)理论上O2可把酒精氧化为CO2,但在酒精检测仪中氧气只能把酒精氧化到乙酸,原电池中阳离子向正极(带负电)移动,故负极的电极反应为:CH?3CH2OH – 4e– + H2O = CH3COOH + 4H+
(3)X、Y、Z、M、G五种分属三个短周期主族元素,且原子序数依次增大,则X为氢元素;Z的核素A质量数为23,中子数为12,则质子数为11,所以M为钠元素;Y、M同主族,可形成MY2、MY3两种分子,则Y、M分别为氧和硫元素,MY2、MY3分别为SO2和SO3,G只能是氯元素。
①核素A的符号为: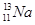 ;②上述五种元素中氯元素的非金属性最强,所以其最高价氧化物的水化物酸性最强,其化学式为:HClO4(高氯酸),高氯酸为强酸,与氢氧化钠溶液反应的离子方程式为:OH– + H+ ?= H2O;③X2M的电子式为H2S,其电子式见答案;④ZG是氯化钠,其用途广泛,可用作调味剂、食物防腐剂、氯碱工业的原料、用于医疗(生理盐水)等。
;②上述五种元素中氯元素的非金属性最强,所以其最高价氧化物的水化物酸性最强,其化学式为:HClO4(高氯酸),高氯酸为强酸,与氢氧化钠溶液反应的离子方程式为:OH– + H+ ?= H2O;③X2M的电子式为H2S,其电子式见答案;④ZG是氯化钠,其用途广泛,可用作调味剂、食物防腐剂、氯碱工业的原料、用于医疗(生理盐水)等。
本题难度:困难