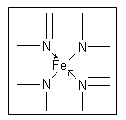
1、填空题 (12分)下图所示为血红蛋白和肌红蛋白的活性部分――血红素的结构式。

回答下列问题:
⑴血红素中含有C、H、O、N、Fe五种元素,C、N、O三种元素的第一电离能由小到大的顺序是?,写出基态Fe原子的核外电子排布式?。
⑵血红素中N原子的杂化方式为?,在右上方的方框内用“→”标出Fe2+的配位键。
⑶铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为?,δ、α两种晶胞中铁原子的配位数之比为?。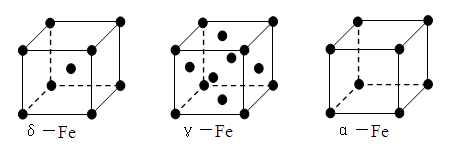
参考答案:(1)C<O<N(2分)[Ar]3d64s2(2分)(2)sp2、sp3(2分)
 (2分)
(2分)
(3)4(2分)? 4:3(2分)
本题解析:(1)同周期元素的自左向右第一电离能依次增大(注意N原子的半充满特例):C<O<N;基态Fe原子的核外电子排布式:[Ar]3d64s2;
⑵根据结构图可看出N原子既有单键还有双键,连双键的两个N原子是sp2杂化,另两个N原子为sp3杂化;
(3)γ晶体晶胞中所含有的铁原子数:8×1/8 + 6×1/2=4
δ晶胞中铁原子的配位数为8,α晶胞中铁原子的配位数为6
本题难度:一般
2、填空题 (10分)X、Y、Z、R、T是原子序数依次增大的短周期主族元素,X、R在周期表中的相对位置如右表所示;X元素最低负化合价的绝对值等于其原子的最外层电子数;Z是地壳中含量最多的金属元素。

(1)X的最高价氧化物的电子式是_________,元素T在周期表中的位置是________________。
(2)Z和T形成的化合物在潮湿的空气中冒白色烟雾,该反应的化学方程式为________________。
(3)Y的最简单气态氢化物甲的水溶液显碱性。在微电子工业中,甲的水溶液可作刻蚀剂H2O2的清除剂,所发生反应的产物不污染环境,其化学方程式为________________。
(4)已知由X和R形成的液态化合物XR2的燃烧热是1075 kj/mol,试写出表示其燃烧热的热化学方程式________________
参考答案:(1)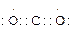 ?第三周期ⅦA族
?第三周期ⅦA族
(2)AlCl3+3H2O==Al(OH)3+3HCl↑
(3)2NH3·H2O+3H2O2=N2↑+8H2O
(4)CS2(l)+3O2(g)=CO2(g)+2SO2(g)?△H=-1075 kJ/mol
本题解析:略
本题难度:简单
3、选择题 某元素Z的核外电子数等于核内中子数,取其单质2.8 g与O2完全反应,可得6 g化合物ZO2,Z 元素在周期表中位置是(?)
①第3周期?②第2周期?③第ⅣA 族?④第ⅤA族
A.①②
B.①④
C.①③
D.②③
参考答案:C
本题解析:有质量守恒定律得出参加反应的氧气质量为6 g—2.8 g="3.2" g,物质的量为3.2/32mol="0.1" mol,所以产物ZO2物质的量也为0.1 mol,则其摩尔质量为60 g/ mol,因而Z的相对原子质量为60—32=28,即其质子数为14,此元素为硅元素,正确因为C.
本题难度:简单
4、选择题 同周期的X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性强弱顺序是:
HXO 4>H2YO4>H3ZO4,则下列各判断中正确的是
A.原子半径 X>Y>Z
B.原子序数 X>Y>Z
C.气态氢化物稳定性 X<Y<Z
D.元素的非金属性 X<Y<Z
参考答案:B
本题解析:非金属性越强,相应最高价氧化物的水化物的酸性就越强。同周期元素自左向右原子半径逐渐增大,金属性逐渐减弱,非金属性逐渐增强,根据题意可知非金属性是,所以原子序数是X>Y>Z,原子半径是X<Y<Z。非金属性越强,氢化物的稳定性就越强,所以正确的答案是B。
本题难度:简单
5、选择题 N的质量数为14,在微粒[NH3T+]中,电子数、质子数、中子数之比说法正确的为?(?)
A.10:7: 11
B.10:11:9
C.10:11:8
D.11:9:10
参考答案:C
本题解析:
正确答案:C
NH3T+ 中电子数:质子数:中子数=10:11:8
本题难度:简单