1、填空题 A、B、C、D、E五种短周期主族元素,原子序数依次增大。A原子的核外电子数等于最外层电子数;B原子的最外层电子数是次外层电子数的2倍;C原子的M层电子数与L层电子数相差7;D原子的最外层电子数是A、B、C三原子的最外层电子数之和。回答下列问题。
(1)元素B在周期表中的位置为第?周期?族;元素D简单离子的结构示意图为?。
(2)元素C、D简单离子的半径由大到小的顺序为(用离子符号表示)?。
(3)元素B可形成离子BH3-,下列与其具有相同电子数和质子数的微粒是?。
A.NH4+? B.OH-? C.F-? D.HS-
(4)元素A、C组成化合物甲CA,甲能与水反应产生一种强碱和一种气体,该反应的化学方程式为?。
(5)A元素有aA、a+1A、a+2A三种同位素,E元素有eE、e+2E两种同位素,二者所形成分子的相对分子质量有?种。
参考答案:(13分)
(1)二(1分);ⅣA(1分);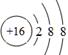 (2分)
(2分)
(2)S2- > Na+(2分)
(3)B C(2分)
(4)NaH + H2O =" NaOH" + H2↑(3分)
(5)5(2分)
本题解析:A原子的核外电子数等于最外层电子数,A为H元素;B原子的最外层电子数是次外层电子数的2倍,B为C元素;C原子的M层电子数与L层电子数相差7,C为Na元素;D原子的最外层电子数是A、B、C三原子的最外层电子数之和,D为S元素;E为Cl元素。
(1)B为C元素,在周期表中的位置为第二周期ⅣA族。D为S元素,原子序数是16,得到2个电子达到稳定结构,离子的结构示意图为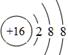 。
。
(2)C为Na元素,易失去一个电子达到稳定结构,电子层为2层,D为S元素,易得到2个电子达到稳定结构,电子层为3层,离子半径大小即S2- > Na+。
(3)注意离子电子数的计算,阴离子是得到电子而形成的,带负电荷,阳离子是原子失去电子而形成的,带正电荷。得失电子数等于其电荷数。
(4)A为H元素,C为Na元素,即CA为NaH,结合题中所给出的信息,方程式为NaH + H2O =" NaOH" + H2↑。
点评:以原子结构与位置关系为载体,考查化学用语、物质结构、半径比较等,难度中等,推断元素是解题关键,是对所学知识的综合运用,注意基础知识的理解掌握。
本题难度:一般
2、选择题 A、B是短周期元素,两元素能形成B2A离子化合物,B+离子比A2-离子少一个电子层,已知A的原子序数为n,则元素B的原子序数是……( )
A、n-5 ?B、n-6 ?C、n-13 ?D、n+13
参考答案:A
本题解析:由于B+离子比A2-离子少一个电子层,则元素A、B为同周期元素,利用这一点,即可通过排除法找到答案。
若B的原子序数取(B)、(C)、(D)的数值时,A、B不在同一周期,与题意不符,故(B)、(C)、(D)不可选。当元素B的原子序数为n-5时,A、B在同一周期,故选A。
本题难度:简单
3、选择题 下列关于四个量子数的说法中,正确的是(?)。
A.电子的自旋磁量子数是±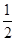 ,表示一个原子轨道中的2个电子的运动状态完全相反
,表示一个原子轨道中的2个电子的运动状态完全相反
B.磁量子数m=0的轨道都是球形的轨道
C.角量子数l的可能取值是从0到n的正整数
D.多电子原子中,电子的能量决定于主量子数n和角量子数l
参考答案:D
本题解析:自旋磁量子数为±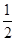 ,只表示一个原子轨道中的两个电子的自旋方向相
,只表示一个原子轨道中的两个电子的自旋方向相
反,既然在同一原子轨道中,它们的主量子数、角量子数和磁量子数都相同,
故A错误;角量子数为零时,对应的为s轨道,在空间呈球形伸展方向,
故B错误;l最大值为(n-1),故C项错误。
本题难度:一般
4、填空题 下表是元素周期表的一部分。表中所列的字母分别代表一种化学元素。

试回答下列问题:
(1)请写出:元素o的基态原子电子排布式_________?
(2)k在空气中燃烧产物的分子构型为?,中心原子的杂化形式为?,该分子是?(填“极性”或“非极性”)分子。
(3)含10电子的d的氢化物分子的VSEPR模型为_______。元素c、a、e按原子个数1:2:1组成生活中常见有甜味分子,该分子中有___个手性碳原子。
(4)g、h、i三种元素的第一电离能由大到小的顺序为________(填元素符号)
(5) 所有元素 其中电负性最大的是___(填图中的序号或元素符号),元素k有两种氧化物,它们对应的水化物的酸性强弱顺序为__________;(填化学式)
参考答案:(13分)(1)1s22s22p63s23p63d64s2
(2)V形或三角形或平面三角形, sp2,极性。
(3)四面体形。4
(4)Mg>Al>Na
(5) f或F; H2SO4>H2SO3? (前五空各1分,后四空各2分)
本题解析:(1)同一周期自左而右,第一电离能呈增大的趋势,同主族自上而下,第一电离能逐渐降低,故第一电离能最小的应在周期表的左下方,第一电离能最大的元素应在周期表的右上方,但稀有气体的第一电离能最大;
由元素在周期表中的位置可知,c、d、e三种元素分别为C、N、O元素,N元素原子的2p能级处于半满稳定状态,能量较低,第一电离能高于同周期相邻的元素;a为H元素,三者与a形成的化合物为氢化物,同周期自左而右,非金属性增强,非金属性越强,氢化物越稳定.
(2)同周期自左而右,电负性增大,故第三周期中电负性最大的元素是Cl,电负性最小的元素是Na.
(3)表中基态原子可以形成+2离子,属于金属,未成对电子数最多,故为过渡元素中的o(Fe),根据核外电子排布规律书写Fe2+的外围电子排布式.
(4)由元素在周期表中的位置可知,a为H元素、d为N元素、e为O元素,三种元素组成的一种离子化合物为硝酸铵,铵根离子水解使溶液呈酸性。
点评:考查元素周期表的结构、元素周期律、核外电子排布规律、盐类水解等,难度中等,注意基础知识的掌握。
本题难度:一般
5、选择题 由H、D.T和35Cl、37Cl生成的氯化氢用一种仪器测定其分子的质量时,所得的数值应有(?)
A.3种? B.2种? C.6种? D.5种
参考答案:D
本题解析:生成的氯化氢分别是H35Cl 、D 35Cl、T 35Cl、H 37Cl?、D 37Cl 、T 37Cl,相对分子质量分别是36、37、38、38、39、40。故所得的数值应有5种。
本题难度:一般