| 高考省级导航 | |
|
|
| 高考省级导航 | |
|
|
|
高考化学知识点总结《物质的量》高频考点预测(2019年最新版)(十)
参考答案:D 本题解析:根据溶液显电中性可知在NaCl、MgCl2、MgSO4形成的混合溶液中,c(Na+)+2c(Mg2+)=c(Cl-)+2c(SO42-),所以溶液中c(SO42-)= 本题难度:一般 2、选择题 用NA表示阿伏加德罗常数的值,下列叙述正确的是 |
参考答案:A
本题解析:A、根据价态归中规律判断在反应KIO3 + 6 HI =" KI" + 3I2 + 3 H2O中,每生成3mo1 I2转移的电子数为5NA,正确;B、乙烯和丁烯的最简式均为CH2,室温下,28.0g乙烯和丁烯的混合气体中CH2的物质的量为2mol,含有的碳原子数目为2NA,错误;C、碳酸钠溶液中存在:H2O + CO32- HCO3- + OH-,故1L0.1mol·L-1碳酸钠溶液中,阴离子总数大于0.1NA ,错误;D.过氧化钠的电子式为
HCO3- + OH-,故1L0.1mol·L-1碳酸钠溶液中,阴离子总数大于0.1NA ,错误;D.过氧化钠的电子式为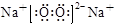 ,1mol Na2O2固体中含离子总数为3 NA,错误。
,1mol Na2O2固体中含离子总数为3 NA,错误。
考点:考查阿伏加德罗常数、相关物质的结构和性质。
本题难度:一般
3、选择题 将20mL0.1mol/L?Al2(SO4)3溶液和20mL?0.1mol/L的Mg?SO4溶液混合,SO42-的物质的量浓度为( )
A.0.2mol/L
B.0.3mol/L
C.0.4mol/L
D.0.5mol/L
参考答案:20mL0.1mol/L?Al2(SO4)3溶液中SO42-?的物质的量为:0.02L×0.1mol/L×3=0.006moL,
20mL?0.1mol/L的Mg?SO4溶液中SO42-?的物质的量为:0.02L×0.1mol/L=0.002mol,
混合后溶液中SO42-?的总物质的量为:0.006moL+0.002mol=0.008mol,
溶液的总体积为:20ml+20ml=40ml,即0.04L,
硫酸根离子物质的量浓度=0.008mol0.04L=0.2mol/L
故选A.
本题解析:
本题难度:一般
4、填空题 质量比为11:7:16的CO2、CO和O2,其物质的量之比是________,它们所含的分子数之比是________,
它们所含的氧原子之比是_____________。
参考答案:1:1:2;1:1:2;2:1:4
本题解析:
本题难度:一般
5、选择题 将4gNaOH固体溶解在水里,配得1L溶液,从中取出10mL,这10mL溶液的物质的量浓度是( )
A.1mol/L
B.0.1mol/L
C.0.01mol/L
D.10mol/L
参考答案:4gNaOH固体的物质的量为4g40g/mol=0.1mol,
所配1L溶液的浓度为0.1mol1L=0.1mol/L.
溶液是均一的,从中取出10mL,这10mL溶液的物质的量浓度与原溶液的浓度相同为0.1mol/L.
故选:D.
本题解析:
本题难度:简单
| 【大 中 小】【打印】 【繁体】 【关闭】 【返回顶部】 | |
| 下一篇:高考化学知识点整理《二氧化硫》.. | |