1、选择题 下列关于砷(As)元素的叙述正确的是
A.在AsCl3分子中砷原子最外层电子数为8
B.Na3AsO4溶液的PH<7
C.砷的氢化物的化学式为AsH3,它是一种强氧化剂
D.砷的相对原子质量为74.92,由此可知砷原子核内有42个中子
参考答案:A
本题解析:试题分析:As是第ⅤA族元素,最外层电子数是5个,所以在AsCl3分子中砷原子最外层电子数为8,A正确;砷酸是弱酸,则砷酸钠水解,溶液显碱性,B不正确;C不正确,应该是还原剂;D不正确,因为砷元素含有同位素,不能确定中子数,答案选A。
考点:考查元素周期律的应用、水解、还原性与氧化性判断以及中子数的计算
点评:该题是中等难度的试题,试题综合性强,难易适中,注重灵活性,侧重对学生解题能力的培养和训练,有助于培养学生的逻辑思维能力和发散思维能力,提高学生分析问题、特别是灵活运用基础知识解决实际问题的能力。
本题难度:一般
2、填空题 在11到18号元素中,除稀有气体元素外(填符号或化学式)
①原子半径最小的元素是_____,原子半径最大的元素是_____;
②非金属性最强的元素是_____,金属性最强的元素是_____;
③最高价氧化物对应水化物碱性最强的是_____,它对应的氧化物的化学式_____;
④最高价氧化物对应水化物酸性最强的是_____,它对应的氢化物的化学式_____;
⑤气态氢化物中最稳定的是_____,最不稳定的是_____。
参考答案:① Cl? ,?Na?;
②?Cl?,?Na?;
③?NaOH?,? Na2O? ;
④?HClO4?,?HCl? ;?
⑤?HCl?,? SiH4? 。
本题解析:
本题难度:一般
3、选择题 X是第二周期元素,能与氧形成X2O5,则有关X的叙述正确的是
A.X的氢化物在固态属于分子晶体
B.X2O5的水化物是一种非氧化性的酸
C.X的单质在常温下以分子晶体形式存在
D.X所在族元素的单质在固态时属于同一晶体类型
参考答案:A
本题解析:
本题难度:困难
4、选择题 A、B、C、D、E、F为短周期六种元素,原子序数依次增大,其中A与E同主族且能形成离子化合物EA,B与F同主族,E与F同周期。D的核电荷数是B的最外层电子数2倍,单质F是一种重要的半导体材料。则下列推断中不正确的是
A.由A、C、D三种元素组成的化合物可以是离子化合物
B.F与D形成的化合物熔点高,可以与某种酸反应
C.五种元素中最高价氧化物对应的水化物酸性最强的是D?
D.原子半径由大到小的顺序是:E>F>C>D
参考答案:C
本题解析:
本题难度:困难
5、推断题 X、Y、Z、W是元素周期表前四周期中的常见元素,其相关信息如下表:

(1)W位于元素周期表第_____周期第_____族,其基态原子最外层有_____个电子。
(2)X的电负性比Y的_____(填“大”或“小”);X和Y的气态氢化物中,较稳定的是_____(写化学式)。
(3)写出Z2Y2与XY2反应的化学方程式。并标出电子转移的方向和数目:?
______________________________
(4)在X的原子与氢原子形成的多种分子中,有些分子的核磁共振氢谱显示有两种氢,写出其中一种分子的名称:_____;氢元素、X、Y的原子也可共同形成多种分子和某种常见无机阴离子,写出其中一种分子与该无机阴离子反应的离子方程式:_________________?
参考答案:(1)4;Ⅷ;2?
(2)小;H2O?
(3)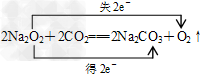
(4)丙烷(或丙炔或2-甲基丙烯或1,2,4,5-四甲基苯等);CH3COOH+HCO3-===CH3COO-+H2O+CO2↑
本题解析:
本题难度:一般