1、选择题 医学研究证明,用放射性13553I治疗肿瘤可收到一定疗效,下列有关13553I叙述正确的是
[? ]
A.13553I是碘的一种同素异形体
C.13553I是一种新发现的元素
B.13553I位于元素周期表中第4周期ⅦA族
D.13553I核内的中子数与核外电子数之差为29
参考答案:D
本题解析:
本题难度:简单
2、简答题 下表是元素周期表的一部分.
族
周期 | | II?A | | IV?A | | | VII?A
1
① |
2
②
③
④
⑤
⑥
⑦
⑧
⑨
⑩
(11)
|
(1)表中所列元素中,最稳定的气态氢化物的化学式______,原子半径最小的元素的元素符号是______.
(2)某元素原子的核外M层电子数是元素②最外层电子数的1/2,则该元素的元素符号是______,其元素原子结构示意图为______.
(3)某元素是组成蛋白质的重要成分,蛋白质又是生命的存在形式,因此此元素被称为“生命元素”,此元素的名称为______,其单质的电子式为______,用化学方程式表示其单质的一种重要的工业用途:______.
(4)④与⑥形成原子个数之比为1:1的化合物的电子式为______,用电子式表示⑤和⑩形成化合物的过程______
(5)写出下列化学方程式
⑤的单质通入⑥和⑨形成化合物的水溶液中______
⑨的单质通入⑥和(11)形成化合物的水溶液中______.
参考答案:根据元素在周期表中的分布,可以推知①是H,②是C,③是N,④是O,⑤是F,⑥是Na,⑦是Al,⑧是S,⑨是Cl,⑩是Ca,(11)是Br.
(1)在周期表中,从左到右的电子能力逐渐增强,从上到下得电子能力逐渐减弱,得电子能力最强的是F,原子半径最小的是H,所以HF是最稳定的氢化物,故答案为:HF;H;
(2)原子的核外M层电子数是C元素最外层电子数的1/2即核外电子排布分别是2、8、2,应为Mg,原子结构示意图为:
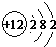
,故答案为:Mg;
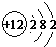
;
(3)氮元素被称为“生命元素”,氮气中含有氮氮三键,电子式为:

,在工业生可以用氮气和氢气来合成氨,即?N2+3H2高温高压
本题解析:
本题难度:一般
3、选择题 下列几组最高价氧化物对应的水化物,酸性按由强到弱顺序排列的是
A.H3PO4? HBrO4? H2SO4? H2CO3
B.H4SiO4? H2CO3? H3GeO3? H3AlO3
C.H2SO4? H2TeO4? HClO4? H2SeO4
D.HClO4? H2SeO4? H3AsO4? H3SbO4
参考答案:D
本题解析:首先应识别各成酸元素并确定其在周期表中的位置,根据位置确定性质.
A选项中,酸性由强到弱的顺序为HBrO4、H2SO4、H3PO4、H2CO3.
B选项中,酸性由强到弱的顺序为H2CO3、H4SiO4、H3GeO3、H3AlO3.
C选项中,酸性由强到弱的顺序为HClO4、H2SO4、H2SeO4、H2TeO4.
当然,解答本题不用逐一排查,只需攻其一点即可.
本题难度:困难
4、简答题
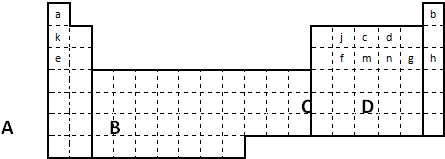
(1)在上面元素周期表中全部是金属元素的区域为______
(a)A?(b)B?(c)C?(d)D
(2)现有甲、乙两种短周期元素,室温下,甲元素单质在冷的浓硫酸或浓硝酸中,表面都生成致密的氧化膜,乙元素原子核外M电子层与K电子层上的电子数相等.
①用元素符号将甲、乙两元素填写在上面元素周期表中对应的位置.
②甲、乙两元素相比较,金属性较强的是______(填名称),可以验证该结论的实
验是______.
(a)将在空气中放置已久的这两种元素的块状单质分别放入热水中
(b)将这两种元素的单质粉末分别和同浓度的盐酸反应
(c)将这两种元素的单质粉末分别和热水作用,并滴入酚酞溶液
(d)比较这两种元素的气态氢化物的稳定性
③写出甲的氧化物及氧化物对应水化物分别与强碱反应的离子方程式
______、______.
(3)表中所列小写字母分别代表一种化学元素:
①m、f、j的单质熔点由高到低的顺序______(填元素符号).
②以上元素形成的金属单质中,熔点最低的是______(填元素符号).
③f、m、n、g所形成的氢化物的稳定性还性由强到弱的顺序为______(填化学式);
④甲、乙、c、d、e形成的简单离子的半径由小到大的顺序为______.
⑤f元素单质是在生产中用量很大,试写出工业上制备f元素单质的化学方程式______.
⑥c元素的单质用途______(填一条).
参考答案:(1)在周期表中,所有的过渡元素均是金属元素,金属元素位于该图中的B区域,故答案为:b;
(2)①室温下,属于短周期的甲元素单质在冷的浓硫酸或浓硝酸中,表面都生成致密的氧化膜,只有金属铝符合要求,所以甲是Al,在第三周期第ⅢA族,原子核外M电子层与K电子层上的电子数相等的元素是Mg,在第三周期,第ⅡA族,故答案为:

;
②同周期从左到右,元素的单质金属性逐渐增强,所以金属镁的金属性较强,可以根据它们和酸反应置换氢气的快慢以及和水反应的剧烈剧烈程度或是看生成的氢氧化物的碱性的强弱,故答案为:Mg;bc;
③氧化铝是两性氧化物,既能和强酸反应又能和强碱反应,反应的实质是:Al2O3 +2OH-═2AlO2-+H2O;Al(OH)3 +OH-═AlO2-+2H2O;
(3)①根据元素周期表的结构和元素的分布,可知m、f、j分别是:P、Si、C,非金属元素,从上到下单质的熔点逐渐升高,从左到右单质的熔点逐渐降低,所以熔点由高到低的顺序为:C>Si>P,故答案为:C>Si>P;
②金属元素,从上到下单质的熔点逐渐降低,从左到右单质的熔点逐渐升高,所以以上元素形成的金属单质中,熔点最低的是Na,故答案为:Na;
③根据元素周期表的结构和元素的分布,可知f、m、n、g分别是:Si、P、S、Cl,同周期元素从左到右,氢化物的稳定性逐渐增强,即HCl>H2S>PH3>SiH4;
④根据元素周期表的结构和元素的分布,可知甲、乙、c、d、e形成的简单离子分别为:Al3+、Mg2+、N3-、O2-、Na+,它们核外电子数相同,则核内质子数越多半径越小,即离子的半径由小到大的顺序为:Al3+、Mg2+、Na+、O2-、N3-;
⑤工业上用焦炭和石英反应来生产粗硅,原理方程式为:SiO2+2C?高温?.? 2CO+Si,故答案为:SiO2+2C?高温?.? 2CO+Si;
⑥氮气是一种重要的工业原料,化学性质稳定,可做保护气,
故答案为:氮气是合成氨、制硝酸的重要原料(由于其性质稳定常被用作保护气;在高科技领域中常用液氮制造低温环境,任选一条回答).
本题解析:
本题难度:一般
5、选择题 已知a为IIA族元素,b为IIIA族元素,它们的原子序数分别为m和n,且A、b为同一周期元素,下列关系式错误的是
[? ]
A.n=m+11
B.n=m+25
C.n=m+10
D.n=m+1
参考答案:C
本题解析:
本题难度:一般