1、选择题 下列各组元素,按原子半径依次增大的顺序排列的是
A.C、N、O
B.N、S、Cl
C.P、S、Cl
D.Al、Mg、Na
参考答案:D
本题解析:
本题难度:一般
2、选择题 X、Y、Z三种元素的核电荷数在1~20之间,它们的最高价氧化物对应的水化物是HXO4、H2YO4、H3ZO4,则下列判断正确的是( )
A.元素的得电子能力:X<Y<Z
B.气态氢化物的稳定性:按X、Y、Z顺序变大
C.含氧酸的酸性:H3ZO4>H2YO4>HXO4
D.元素负化合价的绝对值:按X、Y、Z顺序变大
参考答案:三种元素的核电荷数在1~20之间,根据它们的最高价氧化物对应的水化物可知化合价分别为X为+7价,Y为+6价,Z为+6价,分别为Cl、S、P元素,则
A.同周期元素从左到右元素的非金属性逐渐增强,则元素的得电子能力:X>Y>Z,故A错误;
B.元素的非金属性:X>Y>Z,非金属性越强,对应的氢化物越稳定,按X、Y、Z顺序变小,故B错误;
C.非金属性越强,对应的最高价氧化物的水化物酸性越强,则含氧酸的酸性:H3ZO4<H2YO4<HXO4,故C错误;
D.根据它们的最高价氧化物对应的水化物可知化合价分别为X为+7价,Y为+6价,Z为+6价,故D正确.
故选D.
本题解析:
本题难度:一般
3、填空题 下图为A、B、C三种短周期元素在周期表的相对位置,且三种元素的原子序数之和为31,又知A元素的单质在空气中含量最高。回答下列问题

(1)A元素的名称为___________,C元素的一种氧化物排放到大气中,是导致形成酸雨的主要物质,该氧化物的化学式为___________。
(2)B元素的某种氢化物通常用于做溶剂,此氢化物的电子式是___________,C元素的阴离子结构示意图是___________,三种元素的原子半径中最小的是___________(填元素符号)。
参考答案:(1)氮;SO2
(2)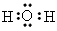 ;
;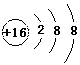 ;O
;O
本题解析:
本题难度:一般
4、选择题 关于元素周期表的说法正确的是
[? ]
A.元素周期表有8个主族
B.元素周期表有7个周期
C.短周期是指第一、二周期
D.IA族的元素全部是金属元素
参考答案:B
本题解析:
本题难度:简单
5、填空题 (1)上表中的实线是元素周期表部分边界,请在表中用实线画出金属元素的边界(实线内的元素全是金属元素)
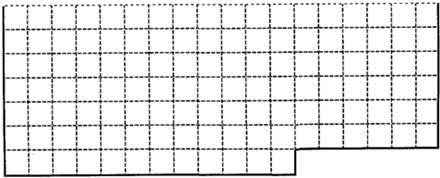
(2)元素甲是第三周期ⅦA族元素,化合物A是由甲元素等非金属元素组成的离子化合物写出其化学式______,
(3)元素乙是第三周期原子半径最小的金属元素,丙是短周期元素中原子半径最大的元素,用电子式表示丙在空气中加热反应生成B的形成过程______.B中含有的化学键是______
(4)化合物C是由甲元素和乙元素形成的化合物,将化合物A与化合物C等物质的量溶于水中,向其中滴加过量的2mol?L-1氢氧化钠溶液,直至形成透明溶液.请根据实验现象出现的先后顺序,依次写出离子方程式:__________________.
(5)实验中丙元素的鉴别方法______(不写过程)与现象______.
参考答案:(1)元素周期表的结构以及元素的分布情况,表示元素周期表的部分边界如下:
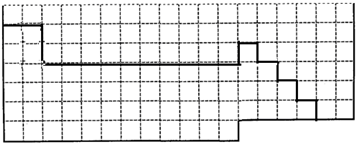
,故答案为:

;
(2)第三周期ⅦA族元素是Cl,由Cl元素等非金属元素组成的离子化合物是氯化铵,故答案为:NH4Cl;
(3)第三周期原子半径最小的金属元素为Al,短周期元素中原子半径最大的元素是Na,钠在空气中加热反应生成过氧化钠,它的形成过程可以表示为:
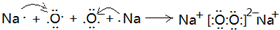
,在过氧化钠中,钠离子和过氧根之间是离子键,过氧根中氧和氧之间是共价键,故答案为:
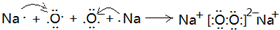
;离子键和非极性键(或离子键和共价键);
(4)化合物C是氯化铝,将化合物氯化铵与化合物氯化铝等物质的量溶于水中,向其中滴加过量的2mol?L-1氢氧化钠溶液,直至形成透明溶液铝离子先和氢氧化钠反应生成氢氧化铝沉淀,然后是铵根离子和氢氧根之间的反应,最后是氢氧化铝溶解的过程,故答案为:Al3++3OH-=Al(OH)3;NH4++OH-=NH3+H2O(NH3?H2O);Al(OH)3+OH-=AlO2-+H2O;
(5)含有钠元素的化合物的检验可以采用颜色反应的方法,颜色反应为黄色,故答案为:焰色反应;火焰呈现黄色.
本题解析:
本题难度:一般