1、选择题 下列关于化学反应速率的说法中,不正确的是( )
A.化学反应速率是衡量化学反应进行快慢程度的物理量
B.化学反应速率通常用单位时间内生成或消耗某物质的质量的多少来表示
C.在同一个反应中,各物质的反应速率之比等于化学方程式中的系数比
D.化学反应速率的常用单位有mol?L-1?S-1和mol/(L?min)
参考答案:A、化学反应有的快,有的慢,则使用化学反应速率来定量表示化学反应进行的快慢,故A正确;
B、化学反应速率常用单位时间内任何一种反应物物质的量浓度的减小或生成物物质的量浓度的增加来表示,故B错误;
C、在同一个反应中,时间相同体积相同,速率之比等于物质的量之比,而物质的量之比等于化学计量数之比,所以各物质的反应速率之比等于化学方程式中的系数比,故C正确;
D、反应速率单位是导出单位,浓度单位常用mol/L,时间单位常用s、min,化学反应速率的常用单位有mol?L-1?S-1和mol/(L?min),故D正确.
故选:B.
本题解析:
本题难度:一般
2、简答题 在密闭容器中发生下列反应:I2(g)+H2(g)?2HI(g)△H>0.起始时,n(H2)=a?mol,n(I2)=b?mol.只改变表中列出的条件,其他条件不变,试将化学反应速率的改变(“增大”、“减小”或“不变”)填入相应的表格.
| 编号 | 反应条件 | 反应速率
①
加入催化剂
______
②
再充入a?mol?H2
______
③
将容器容积扩大为原来2倍
______
④
容器容积不变,通入b?mol?Ne(g)
______
参考答案:①增加入催化剂,反应速率增大,故答案为:增大;?
②再充入a?molH2,反应物浓度增大,化学反应速率增大,故答案为:增大;
③将容器容积扩大为原来2倍,相当于减小压强,则反应速率减小,故答案为:减小;
④容器容积不变,通入b?mol?Ne(g),反应体系中各物质的浓度不变,则反应速率不变,故答案为:不变.
本题解析:
本题难度:一般
3、选择题 下列说法中有明显错误的是
A.对有气体参加的化学反应,增大压强,体系体积减小,可使单位体积内活化分子数增加,因而反应速率增大
B.活化分子之间发生的碰撞不一定为有效碰撞
C.升高温度,一般可使活化分子的百分数增大,因而反应速率增大
D.加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率
参考答案:D
本题解析:A、对有气体参加的化学反应,增大压强,体系体积减小,可增大单位体积内活化分子的个数,从而使有效碰撞次数增大,因而反应速率增大,但活化分子的百分数不变,A正确,不符合题意;B、活化分子之间发生的碰撞不一定为有效碰撞,只有能转化为生成物的碰撞才是有些碰撞,B正确,不符合题意;C、升高温度可增大单位体积内活化分子数以及活化分子个数,从而使有效碰撞次数增大,化学反应速率增大,C正确,不符合题意;D、催化剂既可以增大反应速率,也可以降低反应速率,所以加入适宜的催化剂,可使活化分子的百分数大大增加,从而成千上万倍地增大化学反应的速率是错误的,答案选D。
本题难度:一般
4、填空题 某温度时,在2 L密闭容器中气态物质X和Y反应生成气态物质Z,它们的物质的量随时间的变化如表所示。
(1)根据表中数据,在图中画出X、Y、Z的物质的量(n)随时间(t)变化的曲线:
t/min
| X/mol
| Y/mol
| Z/mol
| 0
| 1.00
| 1.00
| 0.00
| 1
| 0.90
| 0.80
| 0.20
| 3
| 0.75
| 0.50
| 0.50
| 5
| 0.65
| 0.30
| 0.70
| 9
| 0.55
| 0.10
| 0.90
| 10
| 0.55
| 0.10
| 0.90
| 14
| 0.55
| 0.10
| 0.90
|
(2)体系中发生反应的化学方程式是 ________________________________;
(3)列式计算该反应在0~3 min时间内产物Z的平均反应速率: 。
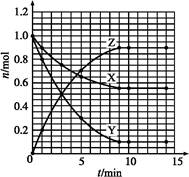
参考答案:(1)
(2)X+2Y 2Z 2Z
(3)="0.083" mol·L-1·min-1
本题解析:(1)根据题目表格信息,可得出下列曲线:
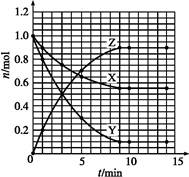
(2)由上图可以看出Z为生成物,X、Y为反应物,再由其数量关系可推出化学方程式为X+2Y 2Z。 2Z。
(3)="0.083" mol·L-1·min-1。
本题难度:一般
5、选择题 在化学反应A(g)+3B(g) 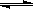 2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是 2C(g)+D(g)中,各物质的平均反应速率间的关系式正确的是
A.vA=vB
B.vA=2vC
C.3vB=vC
D.vB=3vD
参考答案:D
本题解析:反应速率之比是相应对化学计量数之比,所以根据反应的方程式可知,正确的答案选D。
本题难度:一般
|