1、选择题 在相同温度下,下列化学反应速率最慢的是( )
A.10mL?0.1mol/L?Na2S2O3+10mL?0.1mol/L?H2SO4
B.5mL?0.1mol/L?Na2S2O3+5mL?0.1mol/L?H2SO4
C.5mL?0.1mol/L?Na2S2O3+5mL?0.05mol/L?H2SO4
D.10mL?0.05mol/L?Na2S2O3+10mL?0.05mol/L?H2SO4
参考答案:A、混合后?Na2S2O3为0.05mol/L,H2SO4为0.05mol/L,
B、混合后?Na2S2O3为0.05mol/L,H2SO4为0.05mol/L,
C、混合后?Na2S2O3为0.05mol/L,H2SO4为0.025mol/L,
D、混合后?Na2S2O3为0.025mol/L,H2SO4为0.025mol/L,
对比A、B,Na2S2O3浓度相同,H2SO4浓度相同,故反应速率v(A)=v(B);
对比B、C,Na2S2O3浓度相同,B中H2SO4浓度较大,故反应速率v(B)>v(C);
对比C、D,H2SO4浓度相同,C中Na2S2O3浓度较大,故反应速率v(C)>v(D);
所以反应速率v(A)=v(B)>v(C)>v(D);
故选D.
本题解析:
本题难度:一般
2、实验题 (9分)实验室用H2O2分解反应制取氧气时,常加入催化剂以加快反应速率,某研究性学习小组为研究催化剂FeCl3的量对O2生成速率的影响,设计了如下三组实验方案(见下表),将表中所给的试剂按一定体积混合后进行反应。
实验编号
试剂
| A
| B
| C
|
10% H2O2/mL
| 20.0
| V1
| V2
|
2mol/L? FeCl3/ mL
| 0
| 5.0
| 10.0
|
H2O/ mL
| V3
| V4
| 0
|
按要求回答下列问题:
(1)欲用右图装置来比较该反应的反应速率快慢,当反应物的浓度、用量及其他影响速率的条件确定之后,可以通过测?推(计)算反应速率。

(2)为实现实验目的,则V1=?,V2=?;
V3=?,V4=?。
(3)根据你所掌握的知识判断,在上述实验中反应速率最快的可能是?(填“实验编号”)
(4)已知Fe3+催化H?2O2分解的机理可分两步反应进行,其中第一步反应为:2Fe3+ + H2O2 ==2Fe2+ + O2↑+ 2H+,则第二步反应的离子方程式为:
?。
参考答案:(1)相同时间内收集气体的体积;(或答收集相同体积的气体所需要的时间)(2分)。
(2)20.0、 20.0、 10.0、 5.0 (各1分)?(3)C (1分)
(4)2Fe2+ + H2O2 + 2H+ ="=" 2Fe3+ + 2H2O(2分)
本题解析:(1)因为反应中生成氧气,所以可以通过收集相同体积的气体所需要的时间来进行计算。
(2)为使实验在相同条件下进行双氧水的量应该相同,且最终溶液的体积要相同,所以V1=20.00ml,V2=20.00ml,V3=10.00ml,V4=5.00ml。
(3)C中催化剂的量最多,所以反应速率可能最快。
(4)因为催化剂在反应前后是不能变的,所以在第二步中亚铁离子要重新生成铁离子,因此正确的反应式为2Fe2+ + H2O2 + 2H+ ="=" 2Fe3+ + 2H2O。
本题难度:一般
3、选择题 体积不变的密闭容器中存在如下反应:2SO2(g)+O2(g)  ?2SO3(g),ΔH<0.某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
?2SO3(g),ΔH<0.某研究小组研究了其他条件不变时,改变某一条件对上述反应的影响,下列分析正确的是
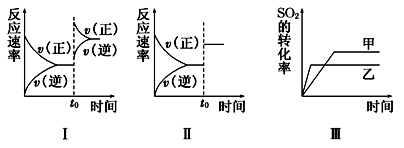
A.图Ⅰ研究的是t0时刻增大O2的浓度对反应速率的影响
B.图Ⅱ研究的是t0时刻加入催化剂后对反应速率的影响
C.图Ⅲ研究的是催化剂对平衡的影响,且甲的催化效率比乙高
D.图Ⅲ研究的是温度对化学平衡的影响,且乙的温度较低
参考答案:B
本题解析:A:在增大O2的浓度的瞬间,逆反应速率不变;B正确;C:催化剂不会影响平衡的移动;D:该反应为放热反应,升高温度,左向移动,反应物转化率减小,故乙的温度较高。故答案为B
本题难度:一般
4、选择题 将一定量的SO2和氧气放入一定体积的密容器中,550℃时在催化剂作用下发生反应:2SO2(g)+2O2 (g) 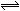 2SO3(g) (正反应放热)。下列能判断该反应达到平衡状态的标志是
2SO3(g) (正反应放热)。下列能判断该反应达到平衡状态的标志是
A.容器中混合气体的密度保持不变
B.每消耗1molO2的同时生成1molSO3
C.容器中气体的压强不变
D.SO3的生成速率与SO2的消耗速率相等
参考答案:C
本题解析:略
本题难度:简单
5、选择题 下列过程中,需要减慢化学反应速率的是( )
A.炼钢
B.炼铁
C.合成纤维
D.食物腐败
参考答案:炼钢、炼铁以及合成纤维等工业生产,为提高产量,都需要提高反应速率,为避免不必要的浪费,应减慢食物腐败.
故选D.
本题解析:
本题难度:简单