1、选择题 在0.1 mol·L-1Na2CO3溶液中,下列关系正确的是?(?)
A.c(Na+)>c(CO32一)>c(OH一)>c(HCO3一)>c(H+)
B.c(Na+)+c(H+)=c(HCO3一)+c(CO32-)+c(OH一)
C.c(Na+)>c(CO32一)>c(HCO3-)>c(H+)>c(OH一)
D.c(HCO3一)+2c(CO32一)+c(H2CO3)="0.1" mol·L-1
参考答案:A
本题解析:略
本题难度:简单
2、填空题 (9分)已知25℃时,CH3COOH和NH3·H2O的电离平衡常数分别为Ka(CH3COOH)=l.7×10-5mol/L,Kb(NH3·H2O)=1.7×l0-5mol/L。现有常温下1 mol/L的醋酸溶液和l mol/L的氨水,且知醋酸溶液的pH=a,试回答下列问题:
(1)醋酸溶液中存在的电离平衡用电离方程式表示为?,
(2)将上述两种溶液等体积混合,所得溶液的pH=?。
(3)饱和氯化铵溶液显酸性,原因是(用离子方程式表示)?;向饱和氯化铵溶液中加入少量Mg(OH)2固体,固体完全溶解。甲、乙两位同学分别提出了不同的解释:
甲同学:由于NH4+水解呈酸性,其H+结合Mg(OH)2电离的OH-,使Mg(OH)2溶解
乙同学:由于Mg(OH)2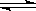 Mg2++2OH-,NH4++OH-
Mg2++2OH-,NH4++OH-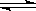 NH3·H2O,使Mg(OH)2溶解。请你设计一个实验验证两位同学的解释?。
NH3·H2O,使Mg(OH)2溶解。请你设计一个实验验证两位同学的解释?。
参考答案:

本题解析:略
本题难度:一般
3、选择题 为了除去MgCl2溶液中的Fe3+,可在加热搅拌的条件下加入的一种试剂是
A.NaOH
B.Na2CO3
C.氨水
D.MgO
参考答案:D
本题解析:选项A、B、C中都能引入新的杂质,不正确。氧化镁能消耗溶液中的氢离子,减弱溶液的酸性,所以可以生成氢氧化铁沉淀而除去,且不会引入杂质,答案选D。
点评:把物质中混有的杂质除去而获得纯净物叫提纯;将相互混在一起的不同物质彼此分开而得到相应组分的各纯净物叫分离。在解答物质分离提纯试题时,选择试剂和实验操作方法应遵循三个原则: 1.不能引入新的杂质(水除外),即分离提纯后的物质应是纯净物(或纯净的溶液),不能有其他物质混入其中;2.分离提纯后的物质状态不变;3.实验过程和操作方法简单易行,即选择分离提纯方法应遵循先物理后化学,先简单后复杂的原则。
本题难度:一般
4、选择题 常温下,下列溶液中的微粒浓度关系正确的是( )
A.新制氯水中加入固体NaOH:c(Na+)=c(Cl-)+c(ClO-)+c(OH-)
B.pH=8.3的NaHCO3溶液:c(Na+)>c(HCO3-)>c(CO32-)>c(H2CO3)
C.常温下,pH=7的NH4Cl与氨水的混合溶液中:c(Cl-)=c(NH4+)>c(OH-)=c(H+)
D.0.1 mol·L-1CH3COONa溶液中:c(OH-)=c(CH3COOH)+c(H+)
参考答案:CD
本题解析:新制氯水中加入氢氧化钠后,反应所得溶液中有电荷守恒式为c(Na+)+ c(H+)=c(Cl-)+c(ClO-)+c(OH-),故A错误;碳酸氢钠溶液显碱性,说明水解大于电离,所以水解产生的c(H2CO3) 大于电离产生的c(CO32-),故B错误;NH4Cl与氨水的混合溶液呈中性,则c(OH-)=c(H+),因此必然有c(Cl-)=c(NH),C正确;CH3COONa溶液有质子守恒c(OH-)=c(CH3COOH)+c(H+),故D正确;故选CD。
本题难度:一般
5、选择题 常温下测得NaA盐溶液的PH值是10,有关盐NaA的说法正确的是?(?)
A.强酸弱碱盐
B.强碱弱酸盐
C.强酸强碱盐
D.弱酸弱碱盐
参考答案:B
本题解析:该溶液水解呈碱性,水解时谁强显谁性;故为强碱弱酸盐。
本题难度:简单