1、选择题 下列说法正确的是
[? ]
A.IA族元素的金属性一定比IIA族元素的金属性强
B.ⅥA族元素中氢化物最稳定的其沸点一定最高
C.非金属元素只能形成共价化合物
D.短周期中,同周期元素的离子半径从左到右逐渐减小
参考答案:B
本题解析:
本题难度:一般
2、选择题 在四种化合物①NaHCO3②Al(OH)3?③Al2O3?④H2N-CH2-COOH中跟盐酸和氢氧化钠溶液都能反应的是?(?)
A.②④
B.①②
C.①②③
D.①②③④
参考答案:D
本题解析:略
本题难度:一般
3、填空题 X、Y、Z是中学化学常见的三 种元素,其中,X、Z位于短周期。常温下,X单质为黄绿色气体;向含Y离子的溶液中滴加氢氧化钠溶液,生成白色絮状沉淀,迅速变为灰绿色,最后变为红褐色;Z的最外层电子数与核外电子总数之比为3:13。请回答下列问题:
(1)Z在元素周期表中的位置是_________ ,X单质分子的电子式是_________。
(2)Z单质与Y的氧化物在高温条件下反应是冶炼Y单质的一种方法,该反应的化学方程式是___________。
(3)含上述元素的某些物质常用于处理工业废水,部分流程如下图:
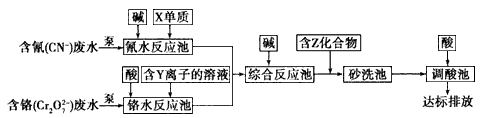
①处理含铬废水时,在反应池中Cr2O72-变为Cr3+,当反应转移1 mol电子时,有____________ mol Cr2O72-转化(计算结果保留两位小数)。
②含Z化合物可以使水中的悬浮颗粒发生凝聚,原因是 ______________(用文字和化学方程式表示)。
③处理含氰废水时,CN-最终转化为两种无毒气体,该反应的离子方程式是_______________。
(4)利用下图装置电解可得到一种新型净水剂K2YO4,阳极的电极反应式为______________。

参考答案:(1)第3周期ⅢA族;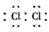
(2) Fe2O3 + 2 Al  Al2O3 +3Fe或 3Fe3O4 +8Al
Al2O3 +3Fe或 3Fe3O4 +8Al  4Al2O3+9Fe
4Al2O3+9Fe
或3FeO +2Al Al2O3 + 3Fe
Al2O3 + 3Fe
(3)①0.17
②Al3+ + 3H2O 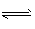 Al(OH)3(胶体)+3H+,氢氧化铝胶体能吸附水中的悬浮颗粒,使之沉淀下来
Al(OH)3(胶体)+3H+,氢氧化铝胶体能吸附水中的悬浮颗粒,使之沉淀下来
③2CN - +5Cl2 +8OH- ==2CO2 + N2 +4H2O + 10Cl-
(4)Fe-6e- +8OH- == FeO42- + 4H2O
本题解析:
本题难度:困难
4、填空题 W、X、Y、Z是原子序数依次增大的同一短同期的元素,W、X是金属元素,Y、Z是非金属元素。回答下列问题:
(1)W、X对应的最高价氧化物的水化物可以反应生成盐和水,该反应的离子方程式为_____________。
(2)X的硝酸盐的水溶液显____性,用离子方程式解释原因________。
(3)Y的低价氧化物通入Z单质的水溶液中,发生反应的化学方程式为________________。
(4)W、X、Y、Z四种元素的简单离子的半径由大到小的顺序是:____>____>____>_____。(填离子符号)
(5)Z的最高价氧化物为无色液体,0.25 mol该物质与一定量的水混合得到一种稀溶液,并放出Q kJ的热量。写出该反应的热化学方程式_________________ 。
参考答案:(1) Al(OH)3 +OH- == AlO2- +2H2O
(2)酸;Al3++3H2O 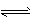 Al(OH)3 +3H+
Al(OH)3 +3H+
(3)SO2+Cl2+2H2O==H2SO4+2HCl
(4)S2->Cl->Na+>Al3+
(5) Cl2O7(1)+H2O(I)==2HClO4 (aq);△H=-4Q kJ/mol
本题解析:
本题难度:一般
5、选择题 我国的“神舟五号”载人飞船已发射成功,“嫦娥”探月工程也已正式启动。据科学家预测,月球的土壤中吸附着数百万吨的 ,每百吨
,每百吨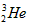 核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氮元素主要以
核聚变所释放出的能量相当于目前人类一年消耗的能量。在地球上,氮元素主要以 的形式存在。下列说法正确的是
的形式存在。下列说法正确的是
[? ]
A.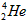 原子核内含有4个质子
原子核内含有4个质子
D. 和
和 互为同位素
互为同位素
C.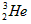 原子核内含有3个中子
原子核内含有3个中子
D.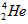 的最外层电子数为2,所以
的最外层电子数为2,所以 具有较强的金属性
具有较强的金属性
参考答案:B
本题解析:
本题难度:简单