1、选择题 某元素X的气态氢化物的化学式是H2X,且X在其最高价氧化物中的质量分数为40%,则该元素是( )
A.Mg
B.S
C.Ca
D.O
参考答案:气态氢化物为H2X中X元素的化合价为-2价,则X元素最高价为+6价,其氧化物为XO3,最高价氧化物含X的质量分数为40%,则XO3的相对分子质量为:16×31-40%=80,则X的相对原子质量为:80-16×3=32,则X为硫元素,
故选B.
本题解析:
本题难度:一般
2、选择题 下列表达方式或说法错误的是( )
A.氯化氢分子的电子式:
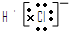
B.32He和42He是两种不同的核素
C.S2-的结构示意图
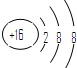
D.ⅦA族元素其简单阴离子的核外电子层数等于该元素所在的周期数
参考答案:A、氯化氢是共价化合物,所以其电子式为:
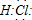
,故A错误.
B、具有一定数目质子和一定数目中子的一种原子称核素,所以3 2He和42He是两种不同的核素,故B正确.
C、硫离子含有16个质子,离子核外含有18个电子,所以硫离子的结构示意图
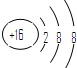
,故C正确.
D、原子结构示意图中,原子的电子层数等于元素所在周期数,ⅤⅡA族元素其简单阴离子与其原子相比,质子数不变,核外电子数变化,但电子层数不变,所以其核外电子层数等于该元素所在的周期数,故D正确.
故选A.
本题解析:
本题难度:一般
3、选择题 A、B是元素周期表中同周期相邻主族的元素,A、B的原子序数依次为a、b且a<b,则a、b之间不可能存在的等式关系是( )
A.b=a+1
B.b=a+11
C.b=a+18
D.b=a+25
参考答案:C
本题解析:
本题难度:一般
4、选择题 已知短周期元素的离子aA2+、bB+、cC2-、dD-具有相同的电子层结构.则下列叙述正确的是( )
A.原子半径 A>B>C>D
B.离子半径 C2->D->B+>A2+
C.原子序数 d>c>b>a
D.原子的失电子能力 A>B>D>C
参考答案:短周期元素的离子aA2+、bB+、cC2-、dD-具有相同电子层结构,核外电子数相等,所以a-2=b-1=c+2=d+1,C、D为非金属,应处于第二周期,故C为O元素,D为F元素,A、B为金属应处于第三周期,A为Mg元素,B为Na元素,
A.根据元素在周期表中的位置可知原子半径Na>Mg>O>F,故A错误;
B.具有相同核外电子排布的离子,核电荷数越大,则半径越小,故B正确;
C.由以上分析可知a=12,b=11,c=8,d=9,则由a>b>d>c,故C错误;
D.元素的金属性越强,则失电子能力越强,同周期元素从左到右元素的金属性逐渐减弱,则有原子的失电子能力:B>A>C>D,故D错误.
故选B.
本题解析:
本题难度:简单
5、简答题 X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,核电荷数按照Z、X、Y、W的顺序增大.已知Z的原子次外层的电子数为2,W、X原子次外层电子数为8.
(1)请写出元素Y的原子结构示意图:______;其中元素W在周期表中的位置:______.
(2)用电子式表示X与W形成化合物的过程:______.
(3)X、Y、Z、W的原子半径由大到小的顺序为:______.(用元素符号表示)
(4)请写出W的单质与X的最高价氧化物对应水化物反应的化学方程式:______.
(5)元素X与元素Y相比,金属性较强的是______(用元素符号表示),请举一例实验事实证明这一结论:______.
参考答案:X、Y、Z、W为短周期的四种元素,其最高正价依次为+1、+3、+5、+7,则分别位于第ⅠA族、ⅢA族、ⅤA族、ⅧA族,核电荷数按照Z、X、Y、W的顺序增大.已知Z的原子次外层的电子数为2,则Z为N元素,W、X原子次外层电子数为8,分别为Cl元素、Na元素,则Y为Al元素,
(1)Y为Al元素,原子核外有3个电子层,最外层电子数为3,位于周期表第三周期、ⅢA族,原子结构示意图为:
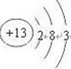
,
故答案为:

;第三周期、ⅢA族;
(2)W、X分别为Cl元素、Na元素,用电子式表示NaCl的形成过程可表示为:
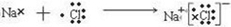
,
故答案为:
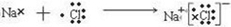
;
(3)X、Y、Z、W分别为:Na、Al、N、Cl,根据同周期元素从左到右原子半径逐渐减小,原子核外电子层数越多半径越大可知:Na>Al>Cl>N,故答案为:Na>Al>Cl>N;
(4)W的单质与X的最高价氧化物对应水化物反应的化学方程式为:Cl2+2NaOH=NaCl+NaClO+H2O,
故答案为:Cl2+2NaOH=NaCl+NaClO+H2O;
(5)Na与Al相比较,金属性较强的为Na,可用过与水反应的剧烈程度比较,故答案为:Na;钠与水反应比铝要剧烈.
本题解析:
本题难度:一般