1、填空题 按照下列元素基态原子的电子排布特征判断元素,并回答问题。
A的原子中只有一个能层且只含1 个电子;B的原子3p轨道上得到1个电子后不能再容纳外来电子;C的原子的2p轨道上有1个电子的自旋方向与其它电子的自旋方向相反;D的原子第三能层上有8个电子,第四能层上只有1个电子;E原子的外围电子排布为3s23p6。
(1)写出由A、B、C、D中的三种元素组成的化合物的化学式(至少写出2个):______________。
(2)写出用上述元素组成的物质制得A的单质的化学方程式(至少写出1个):___________________;
(3)检验某溶液中是否含有D+的离子,可通过______________反应来实现;检验某溶液中是否含有B-的离子,通常所用的试是_________和_______。
(4)写出E的元素符号___________,要证明太阳上是否含有E元素,可采用的方法是______________________。
参考答案:“略”
本题解析:
本题难度:一般
2、简答题 Q、R、X、Y、Z五种元素的原子序数依次递增.已知:①Z的原子序数为29,其余的均为短周期主族元素;②Y原子价电子(外围电子)排布msnmpn③R原子核外L层电子数为奇数;④Q、X原子p轨道的电子数分别为2和4.请回答下列问题:
(1)Z2+的核外电子排布式是______
(2)Q与Y形成的最简单气态氢化物分别为甲、乙,下列判断正确的是______.
A.稳定性:甲>乙,沸点:甲>乙?B.稳定性:甲>乙,沸点:甲<乙
C.稳定性:甲<乙,沸点:甲<乙?D.稳定性:甲<乙,沸点:甲>乙
(3)Q、R、Y三种元素的第一电离能数值由小到大的顺序为______(用元素符号作答).
(4)五种元素中,电负性最大与最小的两种非金属元素形成的化合物的化学式为______.
(5)Q的一种氢化物相对分子质量为28,其中分子中的σ键与π键的键数之比为______,该氢化物与氧气形成的燃料电池在碱性电解质中负极反应为______.
参考答案:Q、R、X、Y、Z五种元素的原子序数依次递增,Z的原子序数为29,为Cu元素,其余的均为短周期主族元素;Q、X原子p轨道的电子数分别为2和4,Q原子的核外电子排布为1s22s22p2,故Q为C元素,X原子的核外电子排布为1s22s22p4,为O元素,Y原子价电子(外围电子)排布msnmpn,n=2,故为第ⅣA族元素,原子序数大于O元素,小于Cu元素,故Y为Si元素,R原子核外L层电子数为奇数,R原子有2个电子层,原子序数介于C元素与O元素之间,故R为N元素,
(1)Cu原子的核外电子排布式是1s22s22p63s23p63d104s1,Cu原子失去4s能级的1个电子及3d能级中的1个电子形成Cu2+,Cu2+的核外电子排布式是1s22s22p63s23p63d9,故答案为:1s22s22p63s23p63d9;
(2)Q形成的最简单气态氢化物甲为CH4,Y形成的最简单气态氢化物乙为SiH4,非金属性C>Si,故稳定性CH4>SiH4
,二者结构相似,都可以形成分子晶体,相对分子质量越大,沸点越高,故沸点CH4<SiH4,
故答案为:B;
(3)同周期自左而右第一电离能增大趋势,同主族自上而下第一电离能降低,故第一电离能Si<C<N,
故答案为:Si<C<N;
(4)非金属性Si<C<N<O,非金属性越强,电负性越大,故电负性最大元素是O元素,电负性最小的非金属元素为Si,二者形成的化合物为SiO2,故答案为:SiO2;
(5)C元素的一种氢化物相对分子质量为28,该氢化物为C2H4,分子中含有4个C-H单键、1个C=C双键,单键是σ键,双键中有1个σ键、1个π键,故分子中有5个σ键、1个π键,分子中的σ键与π键的键数之比为5:1,乙烯与氧气形成的燃料电池在碱性电解质中,负极发生氧化反应,乙烯在负极放电,碱性条件下生成碳酸根离子与水,电极反应式为:
C2H4+16OH--12e-=2CO32-+10H2O,故答案为:5:1,C2H4+16OH--12e-=2CO32-+10H2O.
本题解析:
本题难度:一般
3、填空题 A、B、C、D四种元素分布在三个不同的短周期,它们的原子序数依次增大,其中B与C为同一周期,A与D为同一主族,C元素的原子核外电子总数是电子层数的4倍,D是所在周期原子半径最大的元素.又知四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体.请回答下列问题:
(1)D在元素周期表中的位置是______.
(2)由A、C两元素可以组成X、Y两种化合物,X在一定条件下可以分解成Y,X的电子式为______.
(3)D与C形成的化合物可与Y反应生成单质Z,该反应的化学方程式为______;若有1mol电子转移,生成Z的物质的量为______mol.
(4)写出实验室制备BA3的化学方程式______.将BA3通入溴水中可发生反应,生成一种单质和一种盐,写出该反应的离子方程式______.
(5)已知B2A4可燃烧生成B的单质和Y,以B2A4、O2、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.该电池负极反应是______.以石墨为电极,用该电池电解100mL饱和食盐水,一段时间后,在两极共收集到224mL气体(标准状况下),此时溶液的pH是(忽略溶液体积的变化)______.
参考答案:A、B、C、D四种元素分布在三个不同的短周期,它们的原子序数依次增大,A的原子序数最小,且是主族元素,则A为H元素;A与D为同一主族,D是所在周期原子半径最大的元素,则D为Na元素;C元素的原子核外电子总数是电子层数的4倍,C的原子序数小于11,则C为O元素;四种元素分别形成的常见单质在常温常压下有三种是气体,一种是固体,Na是固体,所以B形成的单质为气体,B与C为同一周期,原子序数B<C,则B为N元素.
由分析可知:A为H元素;B为N元素;C为O元素;D为Na元素.
(1)D为Na元素,质子数为11,有3个电子层,最外层有1个电子,处于周期表第三周期第ⅠA族,故答案为:第三周期第ⅠA族;
(2)A为H元素,C为O元素,两元素形成的化合物为H2O、H2O2,H2O2分解生成H2O,所以X是H2O2、Y是H2O,H2O2是共价化合物氧原子与氢原子之间形成1对共用电子对,氧原子与氧原子之间形成1对共用电子对,H2O2的电子式为
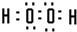
,故答案为:
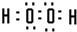
;
(3)Y是H2O,D与C形成的化合物可与Y反应生成单质Z,则D与C形成的化合物是Na2O2,反应方程式为2?Na2O2+2H2O=4NaOH+O2↑;由方程式可知,反应中Na2O2既是氧化剂也是还原剂,物质的量之比为1:1,每生成1molO2转移2mol电子,所以有1mol电子转移,生成O2的物质的量为1mol×12=0.5mol,故答案为:2Na2O2+2H2O=4NaOH+O2↑;0.5;
(4)BA3的是NH3,实验室制取NH3的方程式为2NH4Cl+Ca(OH)2?△?.?CaCl2+2NH3↑+2H2O,
溴具有强氧化性,NH3通入溴水中可发生反应,生成单质为N2,生成的盐为NH4Br,反应离子方程式为8NH3+3Br2=N2+6NH4++6Br-,
故答案为:2NH4Cl+Ca(OH)2?△?.?CaCl2+2NH3↑+2H2O;8NH3+3Br2=N2+6NH4++6Br-;
(5)B2A4为N2H4,N2H4燃烧生成H2O和N2,以N2H4、O2、氢氧化钾溶液为原料,石墨为电极可构成燃料电池.负极发生氧化反应,N2H4在负极放电生成N2和H2O,该电池负极反应是N2H4+4OH--4e-═N2+4H2O.
电解100mL饱和食盐水,一段时间后,在两极共收集到224mL气体为氯气和氢气,混合气体的物质的量为0.224L22.4L/mol=0.01mol,由2NaCl+2H2O?通电?.?2NaOH+Cl2↑+H2↑可知,生成的氯气和氢气的物质的量相等为0.005mol,所以生成的氢氧化钠的物质的量为0.01mol,所以c(OH-)=0.01mol0.1L=0.1mol/L,所以c(H+)=10-1410-1=10-130.1mol/L,所以溶液PH=-log10-13=13,故答案为:N2H4+4OH--4e-═N2+4H2O;13.
本题解析:
本题难度:一般
4、填空题 有A、B、C、D四种短周期元素,它们的原子序数由A到D依次增大,已知A和B原子有相同的电子层数,且A的一种单质硬度很大,C燃烧时使火焰呈现黄色,C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物E,试根据以上叙述回答:
(1)元素名称:A______?B______?C______?D______
(2)E与A的最高价氧化物反应的方程式为______
(3)D在周期表中的位置______,
(4)9克A单质充分燃烧后的产物通人1L?1mol/LNaOH溶液中,所得溶液的溶质及其物质的量为______.
(5)写出D的最高价氧化物的水化物和A反应的化学方程式:
______.
参考答案:(1)C燃烧时使火焰呈现黄色.则C为Na;C的单质在高温下与B的单质充分反应,可以得到与D单质颜色相同的淡黄色固态化合物E,则B为O、E为Na2O2、D为S;A和B原子有相同的电子层数,且A的一种单质硬度很大,则A为C.
故答案为:碳,氧,钠,硫;
(2)过氧化钠与二氧化碳反应生成碳酸钠和氧气,反应的化学方程式为2Na2O2+2CO2=2Na2CO3+O2↑,
故答案为:2Na2O2+2CO2=2Na2CO3+O2↑;
(3)硫元素在第三周期,ⅥA主族,故答案为:第三周期 第VIA族;
(4)9g碳完全燃烧生成0.75mol二氧化碳,通入含1mol氢氧化钠的溶液中,0.5molCO2与NaOH反应生成0.5molNa2CO3,剩余0.25molCO2与0.25molNa2CO3反应生成0.5molNaHCO3,故答案为:0.25molNa2CO3 0.5molNaHCO3;
(5)D的最高价氧化物的水化物是硫酸,浓硫酸与碳反应生成二氧化碳、二氧化硫和水,
反应的化学方程式为C+2H2SO4(浓) ?△?.? CO2↑+2SO2↑+2H2O,
故答案为:C+2H2SO4(浓) ?△?.? CO2↑+2SO2↑+2H2O.
本题解析:
本题难度:简单
5、选择题 在人体所需的十多种微量元素中,有一种称为“生命元素”的R元素,对延长人类寿命起着重要的作用.已知R元素的原子有四个电子层,其最高价氧化物分子式为RO3,则R元素的名称为( )
A.硫
B.砷
C.硒
D.硅
参考答案:根据题意,R元素最高价氧化物化学式为RO3,利用化合物中元素化合价代数和为零,设R元素的化合价为a,则a+(-2)×3=0,解得a=+6,即R元素最多可失去6个电子,可推断R元素的原子结构中最外层为6个电子;又因为,R元素的原子核外有4个电子层,根据电子排布规律,则R元素的原子结构中核外电子分布为2、8、18、6,一共有34个电子.根据质子数=核电荷数=核外电子数,故R元素为34号元素.34号元素为硒元素,
故选C.
本题解析:
本题难度:简单