1、选择题 下述实验中不能达到预期实验目的的是(?)?
编号
| 实验内容
| 实验目的
|
A
| C2H5Cl和NaOH溶液混合后振荡再加入AgNO3溶液
| 检验C2H5Cl中的Cl元素
|
B
| 向沸腾的水中滴加FeCl3饱和溶液,继续煮沸至溶液呈红褐色为止
| 制备Fe(OH)3胶体
|
C
| 室温下,分别向2支试管中加入相同体积、相同浓度的Na2S2O3溶液,再分别加入相同体积不同浓度的稀硫酸
| 研究浓度对反应速率的影响
|
D
| 室温下,用pH计测定浓度各为0.1mol/LNa2CO3溶液和CH3COONa溶液的pH
| 比较H2CO3和CH3COOH的酸性强弱
参考答案:A
本题解析:略
本题难度:一般
2、选择题 仅由右图装置(夹持和加热装置略去),难以完成的实验是( )
A.由乙酸制备乙酸乙酯
B.由碳制备饱和碳酸氢钠溶液
C.证明氯的非金属性比硫强
D.证明酸性:硫酸>碳酸>硅酸
|

参考答案:A.乙酸和乙醇可以发生酯化反应,实质是:酸掉羟基醇掉氢,即CH3COOH+C2H5OH浓硫酸
本题解析:
本题难度:简单
3、实验题 他们只利用Cu、Fe、Mg和不同浓度的硫酸(0.5mol/L、2mol/L、18.4mol/L),设计实验方案来研究影响反应速率的因素。甲同学研究的实验报告如下表:

(1)该同学的实验目的是____________;要得出正确的实验结论,还需控制的实验条件是________。
(2)乙同学为了更精确地研究浓度对反应速率的影响,利用下图装置进行定量实验。完成该实验应选用的实验药品是___________;应该测定的实验数据是_____________。

参考答案:(1)反应物本身的性质对反应速率的关系;温度相同
(2)Mg(或Fe)和0.5mol/L硫酸和2mol/L硫酸;测定一定时间产生气体的体积(或者测定一定体积的气体所需时间)
本题解析:
本题难度:一般
4、选择题 下列有关实验原理或操作正确的是?
A.仅用硝酸银溶液便可鉴别亚硝酸钠和食盐
B.减压过滤是为了加快过滤速度,得到较大颗粒的晶体
C.硫酸亚铁铵晶体过滤后用无水乙醇洗涤
D.纸层析法分离铁离子和铜离子实验中,展开剂的成份为蒸馏水与丙酮
参考答案:C
本题解析:略
本题难度:一般
5、简答题 美国科学家理查德一海克和日本科学家根岸英一、铃木彰因在研发“有机合成中的钯催化的交叉偶联”而获得2010年度诺贝尔化学奖.有机合成常用的钯/活性炭催化剂,长期使用催化剂会被杂质(如:铁、有机物等)污染而失去活性,成为废催化剂,需对其再生回收.一种由废催化剂制取氯化钯的工艺流程如下:
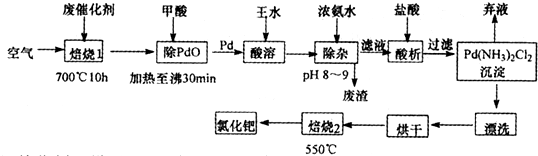
(1)废钯催化剂经烘干后,再在700℃的高温下焙烧,焙烧过程中需通入足量空气的原因是______;甲酸还原氧化钯的化学方程式为______.
(2)钯在王水(浓硝酸与浓盐酸按体积比1:3)中转化为H2PdCl4,硝酸还原为NO,该反应的化学方程式为______.
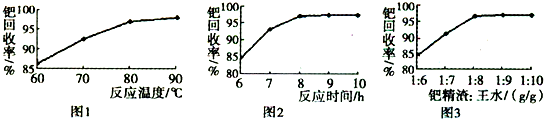
(3)钯精渣中钯的回收率高低主要取决于王水溶解的操作条件,已知反应温度、反应时间和王水用量对钯回收率的影响如图1~图3所示,则王水溶解钯精渣的适宜条件(温度、时间和王水用量)为______、______、______.
(4)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,此时铁的存在形式是______(写化学式).
(5)700℃焙烧1的目的是:______;550℃焙烧2的目的是:______.
参考答案:废钯催化剂经烘干后,再在700℃的高温下焙烧,Fe、Pd、有机物被氧气氧化生成氧化物,向氧化物中加入甲酸,甲酸和氧化铁反应生成盐和水,PdO和甲酸发生氧化还原反应生成Pd,滤渣中含有Pd、SiO2,二氧化硅不溶于王水,但Pd能溶于王水生成溶液,同时生成气体,加入浓氨水调节溶液PH沉淀铁离子,得到溶液中中加入盐酸酸析得到沉淀Pd(NH3)2Cl2 ,通过脱氨等一系列操作得当氯化钯.
(1)废钯催化剂中含有碳单质,碳和氧气反应生成二氧化碳,为了使碳充分燃烧,要通入过量空气;钯被氧气氧化生成PdO,PdO和HCOOH发生氧化还原反应生成Pd、CO2和H2O,反应方程式为PdO+HCOOH=Pd+CO2↑+H2O,
故答案为:使活性炭充分燃烧而除去;PdO+HCOOH=Pd+CO2↑+H2O;
(2)在反应中Pt元素的化合价变化为0→+4,1个Pt原子的变化数为4,N元素的化合价变化为+5→+2,1个N原子的变化数为3,则为保证化合价升降数相等,然后根据Pt原子个数相等,由N原子,Cl原子守恒,然后再根据原子守恒配氢和氧元素,得3Pt+4HNO3+18HCl═3H2PtCl6+4NO↑+8H2O,
故答案为:3Pt+4HNO3+18HCl═3H2PtCl6+4NO↑+8H2O;
(3)根据图象知,温度越高钯回收率越大,反应时间越长钯回收率越大,钯精渣与王水的质量比越大钯回收率越大,但90℃左右时温度再高钯回收率增大不大;8h后,随着时间的增长,钯回收率增大不大;当钯精渣与王水的质量比为1:8后,再增大钯精渣和王水的质量比,但钯回收率不大,所以适宜条件是80~90℃(或90℃左右)、反应时间约为8h、钯精渣与王水的质量比为1:8,
故答案为:80~90℃(或90℃左右);反应时间约为8h;钯精渣与王水的质量比为1:8;
(4)加浓氨水时,钯转变为可溶性[Pd(NH3)4]2+,碱性溶液中铁离子钡沉淀为氢氧化铁,故答案为:Fe(OH)3;
(5)在700℃的高温下焙烧,C、Fe,有机物被氧气氧化生成氧化物,除去活性炭和有机物;550℃焙烧2的目的是脱氨将Pd(NH3)2Cl2变化为PdCl2,
故答案为:除去活性炭和有机物;脱氨将Pd(NH3)2Cl2变化为PdCl2.
本题解析:
本题难度:一般