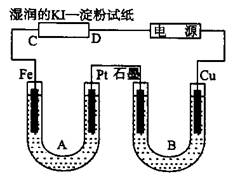
1、填空题 如图所示,装置B部分盛有1 L?2 mol/L Na2SO4溶液,装置A部分盛有1 L?2 mol/L?AgNO3溶液。通电后,湿润的KI淀粉试纸的C端变蓝色,试回答下列问题:
 ?
?
⑴A中发生反应的化学方程式为?。
⑵在B中观察到的现象是?。
⑶室温下,若从电解开始到时间为T时,A、B装置中共收集到气体0.168L(标准状况),若电解过程中无其它副反应发生,且溶液体积变化忽略不计,则在时间T时,A溶液的c(H+)为?。
参考答案:⑴4AgNO3?+? 2H2O?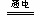 ?4Ag?+? O2↑+? 4HNO3;⑵石墨电极表面有气泡产生,铜电极周围溶液变蓝,一段时间后U形管下面有蓝色沉淀产生;⑶0.0100mol·
?4Ag?+? O2↑+? 4HNO3;⑵石墨电极表面有气泡产生,铜电极周围溶液变蓝,一段时间后U形管下面有蓝色沉淀产生;⑶0.0100mol· 。
。
本题解析:由湿润的KI淀粉试纸的C端变蓝色,可知在C端I-被氧化成I2,即C端为阳极,进而得到电源的右端为正极,左端为负极,由此得A装置中Fe棒为阴极,Pt为阳极,则A中电解的总反应式为:4AgNO3?+? 2H2O?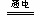 ?4Ag?+? O2↑+? 4HNO3。B装置中Cu棒为阳极,由此得到B中的现象为石墨电极表面有气泡产生,铜电极周围溶液变蓝,一段时间后U形管下面有蓝色沉淀产生,A、B装置收集的气体分别是O2和H2,有电子守恒得,n(O2)=
?4Ag?+? O2↑+? 4HNO3。B装置中Cu棒为阳极,由此得到B中的现象为石墨电极表面有气泡产生,铜电极周围溶液变蓝,一段时间后U形管下面有蓝色沉淀产生,A、B装置收集的气体分别是O2和H2,有电子守恒得,n(O2)=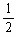 n(H2),所以,n(O2)=
n(H2),所以,n(O2)= ×
×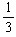 =0.0025mol,由A总反应得n(HNO3)= 4n(O2)=0.0100mol,故c(H+)=
=0.0025mol,由A总反应得n(HNO3)= 4n(O2)=0.0100mol,故c(H+)= 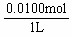 =0.0100mol·
=0.0100mol· 。
。
本题难度:一般
2、填空题 用惰性电极电解NaCl与NaHCO3的混合溶液,测得溶液的pH变化如图所示。
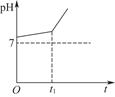
(1)在0→t1时间内,两个电极上的电极反应式为:
阳极:________________________________________________________________________;
阴极:________________________________________________________________________。
(2)用离子方程式表示0→t1时间内,溶液pH升高比较缓慢的原因:____________________________________________________________________________。
参考答案:(1)2Cl--2e-=Cl2↑ 2H++2e-=H2↑
(2)HCO3-+OH-=CO32-+H2O
本题解析:由于HCO3-、Na+均不易放电,故阳极反应式为2Cl--2e-=Cl2↑;阴极反应式为2H++2e-=H2↑。随着反应的进行c(OH-)增大,HCO3-+OH-=CO32-+H2O,故而开始pH变化缓慢,当HCO3-完全反应后,pH增幅加大。
本题难度:一般
3、填空题 (15分,除标明外,其余每空2分)由黄铜矿(主要成分是CuFeS2)炼制精铜的工艺流程示意图如下:

(1)在反射炉中,把铜精矿砂和石英砂混合加热到1000°C左右,黄铜矿与空气反应生成Cu和Fe的低价硫化物,且部分Fe的硫化物转变为低价氧化物,该过程中两个主要反应的化学方程式分别是 ,
反射炉内生成炉渣的主要成分是 ;
(2)冰铜(Cu2S和FeS互相熔合而成)含Cu量为20%~50%。转炉中,将冰铜加熔剂(石英砂)在1200°C左右吹入空气进行吹炼。冰铜中的Cu2S被氧化成Cu2O,生成的Cu2O与Cu2S反应,生成含Cu量约为98.5%的粗铜,该过程发生反应的化学方程式分别是 ? ;
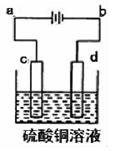
(3)粗铜的电解精炼如图所示。在粗铜的电解过程中,粗铜板应是图中电极 (填图中的字母);在电极d上发生的电极反应式为 ;若粗铜中还含有Au?Ag?Fe,它们在电解槽中的存在形式和位置为 。
参考答案:(15分,除标明外,其余每空2分)
(1)2Cu2FeS2+O2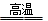 Cu2S+2FeS+ SO2 2FeS+3O2
Cu2S+2FeS+ SO2 2FeS+3O2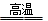 2FeO+2SO2 FeSiO3
2FeO+2SO2 FeSiO3
(2)2Cu2S+3O2===2Cu2O+2SO2 2Cu2O+ Cu2S="==6" Cu+ SO2↑
(3)c Cu2++2e-=Cu Au?Ag以单质的形式沉积在c(阳极)下方,Fe以Fe2+的形式进入电解液中
本题解析:(1)黄铜矿与空气反应生成Cu和Fe的低价硫化物,即生成硫化亚铁和硫化亚铜,根据元素守恒,同时有二氧化硫生成,化学方程式是2Cu2FeS2+O2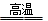 Cu2S+2FeS+ SO2;且部分Fe的硫化物转变为低价氧化物,则FeS与氧气反应生成FeO和二氧化硫,化学方程式是2FeS+3O2
Cu2S+2FeS+ SO2;且部分Fe的硫化物转变为低价氧化物,则FeS与氧气反应生成FeO和二氧化硫,化学方程式是2FeS+3O2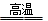 2FeO+2SO2;因为冰铜是Cu2S和FeS互相熔合而成,所以反射炉中的石英砂与生成的FeO反应生成FeSiO3,所以炉渣的主要成分是FeSiO3;
2FeO+2SO2;因为冰铜是Cu2S和FeS互相熔合而成,所以反射炉中的石英砂与生成的FeO反应生成FeSiO3,所以炉渣的主要成分是FeSiO3;
(2)冰铜中的Cu2S被氧化成Cu2O,同时有二氧化硫生成,化学方程式是2Cu2S+3O2===2Cu2O+2SO2;生成的Cu2O与Cu2S反应,生成Cu单质,同时有二氧化硫生成,化学方程式是2Cu2O+ Cu2S="==6" Cu+ SO2↑;
(3)粗铜的精炼中,粗铜作电解池的阳极与电源的正极相连,所以粗铜是图中的c极;d为阴极,发生还原反应,铜离子得到电子生成Cu,电极反应式为Cu2++2e-=Cu;粗铜中的Ag、Au的活性比Cu弱,所以在阳极以单质形式沉积下来,形成阳极泥,而Fe的活性比Cu强,所以先失去电子生成Fe2+进入溶液。
考点:考查粗铜的制取与精炼,化学方程式的判断与书写,电解反应原理的应用
本题难度:困难
4、选择题 下图中X、Y分别是直流电源的两极,通电后发现a电极质量增加,b电极处有无色无味气体放出。符合这一情况的是表中的

参考答案:A
本题解析:通电后发现a极板质量增加,说明金属阳离子在a极得电子,a极是阴极,B项是用惰性电极电解NaOH溶液,阴极氢离子得电子生成氢气,B项错误;C.a极与电源的负极相连,X为负极,C项错误;D. 电解CuCl2溶液,阳极产生黄绿色的气体,而实际上b极是阳极,b极板处有无色无臭气体放出,D项错误;选A。
考点:考查电解池的工作原理。
本题难度:一般
5、选择题 如图8-4,当阴极增重2.16g时,下列判断正确的是?
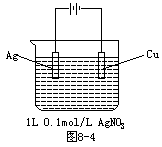
A.[AgNO3]=0.08mol/L
B.阳极产生112mL气体(标况)
C.有1.204×1023个电子转移
D.反应中有0.02mol物质被氧化
参考答案:D
本题解析:此装置为电镀池:
阳极:Ag-e=Ag+;阴极(Cu):Ag++e=Ag,所以阴极增重的2.16g为

个,所以C错误。
本题难度:一般